Thuốc Tagrix 80mg
Chỉ định:
- Thuốc Tagrix 80mg được sử dụng để điều trị ung thư phổi không phải tế bào nhỏ ở giai đoạn tiến triển hoặc di căn mà có đột biến EGFR (T790M, L858R và Exon 19).
- Thuốc Tagrix 80mg được sử dụng để điều trị ung thư phổi không phải tế bào nhỏ khi đã thất bại với các phương pháp điều trị khác.
Bệnh nhân trưởng thành: 80 mg, 1 lần/ngày cho đến khi bệnh tiến triển trở lại hoặc xuất hiện độc tính không thể chấp nhận; ngưng và/hoặc chỉnh liều dựa trên mức độ an toàn và dung nạp (nếu cần: giảm xuống 40 mg, 1 lần/ngày). Nếu quên 1 liều, nên uống ngay trừ phi liều kế tiếp sẽ được dùng trong vòng 12 giờ.
Ngưng dùng: Nếu (1)QTc >500 mili giây trên tối thiểu 2 lần đo ECGs riêng biệt: cho đến khi QTc < 481 mili giây hoặc hồi phục về mức cơ bản nếu mức cơ bản QTc ≥ 481 mili giây, sau đó khởi đầu lại với liều 40mg; (2)phản ứng ngoại ý cấp độ 3 hoặc lớn hơn: cho đến 3 tuần, sau đó nếu có cải thiện xuống cấp độ 0-2, có thể khởi đầu lại với liều 80mg hoặc giảm 40mg.
Ngưng dùng vĩnh viễn: Nếu xảy ra bệnh phổi mô kẽ/viêm phổi; QTc kéo dài kèm dấu hiệu/triệu chứng loạn nhịp trầm trọng; phản ứng ngoại ý cấp độ 3 hoặc lớn hơn không được cải thiện xuống cấp độ 0-2 sau khi ngưng dùng cho đến 3 tuần. Các nhóm bệnh nhân đặc biệt (tuổi, cân nặng, giới tính, chủng tộc hoặc tình trạng hút thuốc); bệnh nhân suy gan nhẹ/trung bình, suy thận nhẹ/trung bình/nặng: không cần chỉnh liều.
Cách dùng: Nuốt nguyên viên với nước (không được nghiền, bẻ hoặc nhai), kèm hoặc không kèm thức ăn, tại cùng thời điểm mỗi ngày. Bệnh nhân không thể nuốt nguyên viên: thả nguyên viên thuốc (không được nghiền) vào ly có 50mL (/ 15mL) nước không chứa carbonate, khuấy đều đến khi thuốc phân tán và uống ngay (/ dùng qua ống thông dạ dày); thêm nửa ly nước tráng ly và uống ngay (/ 15mL tráng cặn ống thông, dùng dịch phân tán và tráng cặn trong vòng 30 phút kể từ khi thuốc được pha vào nước); không dùng thêm bất kỳ chất lỏng nào khác.
Chống chỉ định: Quá mẫn với cảm với thuốc và các thành phần của thuốc. Dùng chung St. John's Wort.
Tác động về dược lực:
Các nghiên cứu in vitro đã cho thấy Tagrix (Osimertinib) có tác động ức chế hiệu quả cao thụ thể EGFR bằng các bước điều trị các tế bào ung thư phổi không phải tế bào nhỏ có đột biến T790M và đột biến EGFRm nhạy cảm trên lâm sàng (xét nghiệm phospho-EGFR cho thấy IC50s rõ rệt từ 6nM đến 54nM). Điều này dẫn đến ức chế sự phát triển của tế bào trong khi cho thấy ít có tác động đáng kể trên EGFR của các tế bào không có đột biến (wild-type cell lines) (xét nghiệm phospho-EGFR cho thấy IC50s rõ rệt từ 480nM đến 1,8μM). Khi dùng Tagrix (Osimertinib) đường uống in vivo làm cho khối u co lại ở cả mẫu khối u ghép ngoại lai và biến đổi gen trên phổi chuột có tế bào ung thư phổi không tế bào nhỏ có đột biến EGFRm và T790M.
Điện tim:
Khả năng kéo dài khoảng QTc khi dùng Tagrix (Osimertinib) đã được đánh giá trên 210 bệnh nhân đang dùng Tagrix (Osimertinib) 80 mg/ngày trong nghiên cứu AURA2. Các giá trị ECG đã được thu thập sau khi dùng 1 liều Tagrix (Osimertinib) và khi thuốc đã nồng độ hằng định để đánh giá tác động của Tagrix (Osimertinib) trên khoảng QTc. Phân tích dược động học dự đoán khả năng kéo dài khoảng QTc liên quan đên thuốc là 14 mili giây ở liều 80 mg với trị số giới hạn trên là 16 mili giây (độ tin cậy 90% CI).
Hiệu quả và an toàn trên lâm sàng
Bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) có đột biến T790M trước khi điều trị - nghiên cứu AURA3
Hiệu quả và tính an toàn của Tagrix (Osimertinib) trong việc điều trị bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) giai đoạn tiến triển tại chỗ hay di căn, có đột biến T790M khi bệnh tiến triển hoặc sau khi điều trị bằng EGFR TKI đã được chứng minh trong nghiên cứu pha 3 ngẫu nhiên, nhãn mở, có đối chứng (AURA3). Tất cả bệnh nhân phải có đột biến EGFR T790M dương tính được xác định qua xét nghiệm đột biến EGFR cobas thực hiện tại phòng thí nghiệm chính trước khi đưa vào điều trị. Tình trạng đột biến T790M cũng được đánh giá qua việc tháo xoắn các DNA khối u trong tuần hoàn (ctDNA) lấy từ mẫu huyết tương trong khi sàng lọc. Mục tiêu chính đánh giá hiệu quả là thời gian sống không bệnh tiến triển (PFS) theo đánh giá của nghiên cứu viên. Các mục tiêu đo lường hiệu quả bổ sung bao gồm tỷ lệ đáp ứng khách quan (objective response rate - ORR), thời gian đáp ứng (DoR) và thời gian sống còn toàn bộ (OS) theo đánh giá của nghiên cứu viên.
Bệnh nhân được phân nhóm ngẫu nhiên dùng thuốc theo tỷ lệ 2:1, tương ứng là dùng Tagrix (Osimertinib) (n=279) hoặc hóa trị bộ đôi có platinum (n=140). Việc dùng thuốc được phân ngẫu nhiên theo chủng tộc (châu Á và không phải châu Á). Bệnh nhân ở nhánh Tagrix (Osimertinib) dùng liều 80 mg uống một lần/ngày cho đến khi không dung nạp với điều trị, hoặc nghiên cứu viên xác định rằng các bệnh nhân không còn lợi ích lâm sàng. Hóa trị gồm pemetrexed 500 mg/m2 với carboplatin AUC5 hoặc pemetrexed 500 mg/m2 với cisplatin 75 mg/m2) vào ngày 1 của mỗi chu kỳ 21 ngày cho đến 6 chu kỳ. Bệnh nhân không tiến triển bệnh sau bốn chu kỳ hóa trị liệu có platinum như trên có thể được điều trị duy trì bằng pemetrexed (pemetrexed 500 mg/m2 vào ngày 1 của mỗi chu kỳ 21 ngày). Những bệnh nhân trong nhánh hóa trị có bệnh tiến triển trên chẩn đoán hình ảnh (theo nghiên cứu viên và được xác định qua chẩn đoán hình ảnh độc lập) sẽ có cơ hội được bắt đầu điều trị bằng Tagrix (Osimertinib).
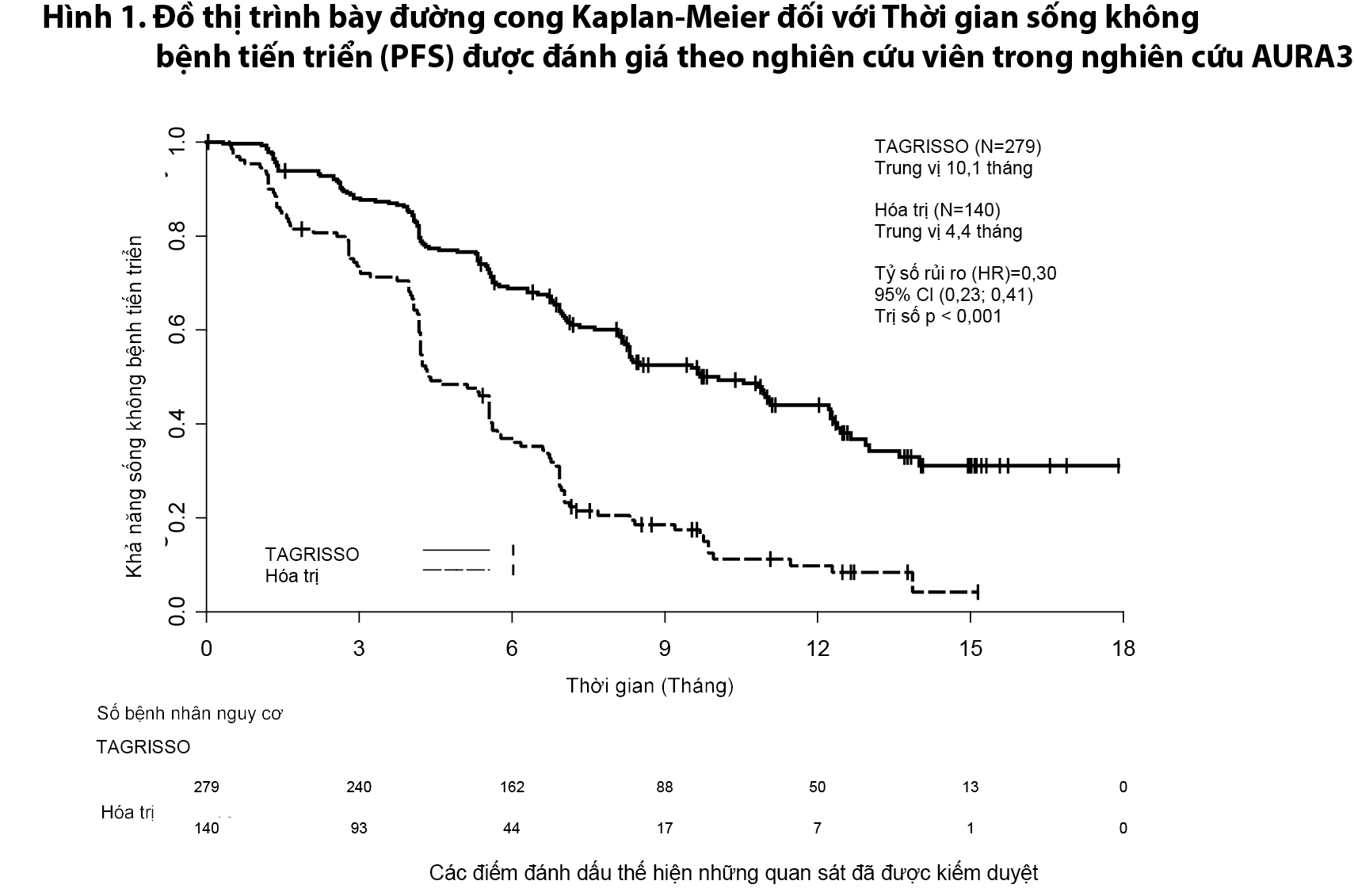
Các đặc tính cơ bản về nhân trắc học và bệnh lý của dân số nghiên cứu là tuổi trung vị 62 tuổi, bệnh nhân ≥ 75 tuổi (15%), phụ nữ (64%), người da trắng (32%), chủng tộc Châu Á (65%), không hút thuốc (68%), 100% bệnh nhân có trị số thể trạng theo WHO là 0 hoặc 1. Có 54% bệnh nhân đã bị di căn tạng ngoài lồng ngực (extra-thoracic visceral metastases), trong đó có 34% bị di căn não (CNS metastases) (được xác định qua sang thương thần kinh trung ương ở mức cơ bản, tiền sử y khoa, và/hoặc phẫu thuật trước đó, và/hoặc xạ trị trước khi di căn não) và 23% di căn gan. Có 41% bệnh nhân bị di căn xương. Nghiên cứu AURA3 cho thấy có cải thiện đáng kể có ý nghĩa thống kê về PFS trên nhánh bệnh nhân điều trị bằng Tagrix (Osimertinib) so với nhánh dùng hóa trị. Bảng 1 tóm tắt kết quả về hiệu quả của nghiên cứu AURA3 theo đánh giá từ nghiên cứu viên và Hình 1 trình bày đồ thị đường cong Kaplan-Meier đối với PFS. Dữ liệu sống còn toàn bộ chưa được hoàn thiện tại thời điểm phân tích OS ban đầu này.
Bảng 1 & Hình 1
Phân tích độ nhạy đối với PFS được Hội đồng độc lập thẩm định mù (BICR) thực hiện đã cho thấy PFS đạt được trung vị là 11,0 tháng ở nhánh Tagrix (Osimertinib) so với 4,2 tháng ở nhánh hóa trị. Phân tích này cho thấy hiệu quả điều trị phù hợp với đánh giá của nghiên cứu viên (HR 0,28; 95% CI: 0,20; 0,38). Cải thiện có ý nghĩa về mặt lâm sàng đối với PFS với tỷ số rủi ro HRs < 0,50 có lợi cho nhánh bệnh nhân dùng Tagrix (Osimertinib) so với nhánh hóa trị, ghi nhận này là nhất quán trong tất cả các phân nhóm xác định trước đã phân tích, bao gồm cả chủng tộc, tuổi tác, giới tính, tiền sử hút thuốc và đột biến EGFR (đột biến mất đoạn ở Exon 19 và đột biến điểm L858R).
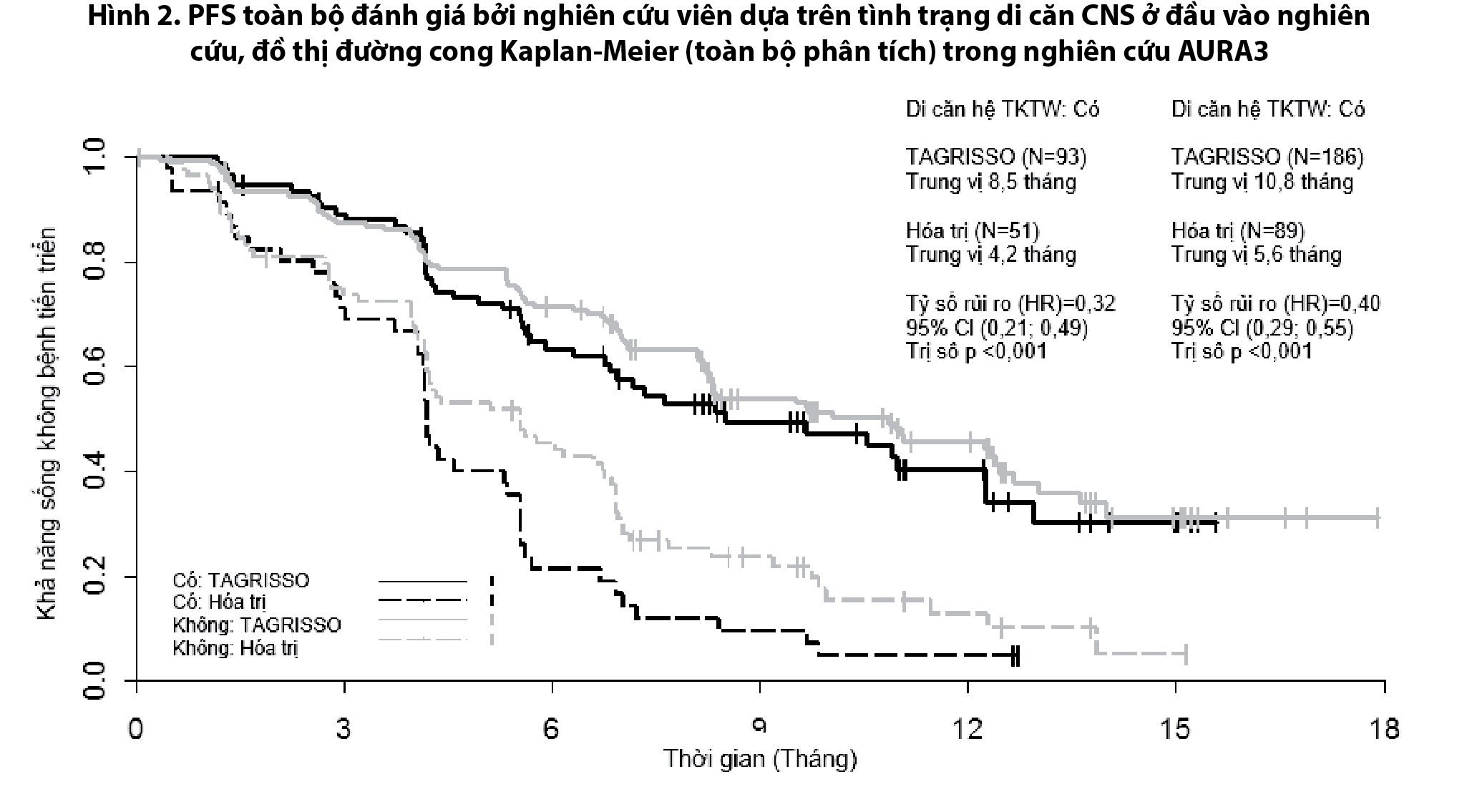
Dữ liệu về hiệu quả trên bệnh nhân di căn não trong nghiên cứu AURA3
Bệnh nhân đủ điều kiện để được chọn ngẫu nhiên vào nghiên cứu là bệnh nhân có di căn não ổn định, không triệu chứng, không được chỉ định dùng corticosteroids trong tối thiểu là 4 tuần trước khi bắt đầu điều trị. Bảng 2 tóm tắt đánh giá của BICR về hiệu quả trên hệ thần kinh trung ương căn cứ theo tiêu chuẩn RECIST v1.1 trên 116 bệnh nhân (chiếm tỷ lệ 28%) đã xác định là di căn hệ thần kinh trung ương bằng phương tiện chẩn đoán hình ảnh sọ não tại thời điểm tham gia nghiên cứu trong tổng số 419 bệnh nhân.
Bảng 2
AURA3 có định trước việc đánh giá PFS cho phân nhóm có di căn trên hệ thần kinh trung ương được xác định tại đầu vào của nghiên cứu, thể hiện ở Hình 2.
Hình 2
AURA3 cho thấy sự cải thiện đáng kể có ý nghĩa thống kê về PFS trên bệnh nhân dùng Tagrix (Osimertinib) so với bệnh nhân dùng hóa trị bất kể tình trạng di căn hệ thần kinh trung ương tại thời điểm tham gia nghiên cứu.
Kết quả do bệnh nhân ghi nhận: Các triệu chứng do bệnh nhân báo cáo (patient-reported symptoms) và chất lượng cuộc sống liên quan đến sức khỏe (health-related quality of life - HRQL) đã được thu thập qua thiết bị điện tử bằng cách sử dụng bảng câu hỏi EORTC QLQ-C30 và bảng câu hỏi chuyên biệt về ung thư phổi (EORTC QLQ-LC13). Bảng câu hỏi LC13 ban đầu được dùng một lần một tuần trong 6 tuần đầu tiên, sau đó mỗi 3 tuần trước và sau khi bệnh tiến triển. Bảng câu hỏi C30 được đánh giá mỗi 6 tuần trước và sau khi bệnh tiến triển.
Phân tích các triệu chứng ung thư phổi chính:Tagrix (Osimertinib) làm cải thiện các triệu chứng ung thư phổi do bệnh nhân báo cáo so với hóa trị qua sự khác biệt có ý nghĩa thống kê về sự thay đổi đáng kể so với ban đầu trên toàn bộ thời gian từ khi phân nhóm ngẫu nhiên cho đến 6 tháng đối với 5 triệu chứng chính được xác định trước (chán ăn, ho, đau ngực, khó thở và mệt mỏi) được thể hiện trong Bảng 3.
Bảng 3
Giá trị trung bình hiệu chỉnh và sự khác biệt ước tính được thu thập từ phép phân tích theo Đánh giá lặp lại mô hình hỗn hợp (Mixed Model Repeated Measures - MMRM). Mô hình này bao gồm bệnh nhân, điều trị, lần thăm khám, tương tác giữa điều trị theo số lần thăm khám, điểm số triệu chứng cơ bản, tương tác giữa số triệu chứng cơ bản theo số lần thăm khám và sử dụng ma trận phương sai không cấu trúc.
Chất lượng cuộc sống liên quan đến sức khỏe (HRQL) và phân tích cải thiện chức năng thể chất (physical functioning improvement analysis): Bệnh nhân dùng Tagrix (Osimertinib) có cơ hội lớn hơn đáng kể đạt được sự cải thiện có ý nghĩa lâm sàng lớn hơn hoặc bằng 10 điểm về tình trạng sức khỏe toàn cầu và chức năng thể chất theo Bảng câu hỏi EORTC C30 so với hóa trị liệu trong thời gian nghiên cứu. Tỷ suất chênh (OR) của tình trạng sức khỏe toàn cầu là: 2,11 (95% CI 1,24; 3,67; p=0,007); Tỷ suất chênh (OR) của chức năng thể chất là: 2,79 (95% CI 1,50; 5,46; p=0,002).
Bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) có đột biến T790M trước khi điều trị - trong nghiên cứu AURAex và AURA2
Các nghiên cứu lâm sàng 2 nhánh riêng lẻ, nhãn mở gồm nghiên cứu đoàn hệ mở rộng pha 2 (AURAex (n=201)) và nghiên cứu pha 2 (AURA2 (n=210)) đã được thực hiện trên bệnh nhân ung thư phổi có đột biến EGFR T790M và bệnh tiến triển sau một hoặc nhiều liệu pháp điều trị toàn thân trước đây, kể cả liệu pháp EGFR TKI. Toàn bộ bệnh nhân được yêu cầu phải có đột biến EGFR T790M dương tính được xác định qua xét nghiệm đột biến EGFR đo bằng hệ thống cobas trong phòng xét nghiệm trung tâm trước khi đưa vào điều trị. Tình trạng đột biến T790M cũng được đánh giá bằng cách đánh giá hồi cứu ctDNA trích xuất từ mẫu huyết tương thu thập trong khi sàng lọc. Toàn bộ bệnh nhân được cho dùng Tagrix (Osimertinib) với liều 80 mg, 1 lần/ngày. Mục tiêu chính đánh giá hiệu quả của hai nghiên cứu này là tỷ lệ đáp ứng khách quan (Objective response rate – ORR) theo tiêu chuẩn RECIST v1.1 bởi BICR. Mục tiêu phụ đo lường hiệu quả bao gồm thời gian đáp ứng (Duration of Response - DoR) và thời gian sống không bệnh tiến triển (Progression-Free Survival - PFS).
Đặc điểm cơ bản của dân số nghiên cứu tổng thể (AURAex và AURA2) như sau: Độ tuổi trung vị 63 năm, bệnh nhân ≥ 75 tuổi (13%), phụ nữ (68%), người da trắng (36%), châu Á (60%). Toàn bộ bệnh nhân đều được nhận ít nhất là điều trị bước 1 trước khi đưa vào nghiên cứu. Ba mươi mốt phần trăm (31%) (N=129) đã nhận điều trị bước 1 trước khi điều trị (bằng EGFR-TKI), 69% (N=282) đã nhận được điều trị bước 2 hoặc nhiều hơn. Bảy mươi hai phần trăm (72%) bệnh nhân là người không hút thuốc, 100% bệnh nhân có chỉ số thể trạng theo Tổ chức Y tế Thế giới (WHO) là 0 hoặc 1. Năm mươi chín phần trăm (59%) bệnh nhân đã có di căn tạng ngoài lồng ngực, trong đó có 39% bệnh nhân bị di căn trên hệ thần kinh trung ương (CNS) (được xác định bởi sang thương trên thần kinh trung ương so với trị số cơ bản, tiền sử y khoa, và/hoặc phẫu thuật trước đó và/hoặc xạ trị trước khi di căn CNS) và 29% có di căn gan. Bốn mươi bảy phần trăm (47%) bệnh nhân có bệnh di căn xương. Thời gian theo dõi trung vị đối với PFS là 12,6 tháng.
Trong 411 bệnh nhân có đột biến EGFR T790M dương tính trước khi điều trị, trị số ORR tổng quát theo đánh giá của BICR là 66% (95% CI: 61; 71). Ở bệnh nhân có đáp ứng đã được xác nhận bởi BICR, DOR trung vị là 12,5 tháng (95% CI: 11,1; NE). ORR theo BICR trong AURAex và AURA2 tương ứng là 62% (95% CI: 55; 68) và 70% (95% CI: 63; 77). PFS trung vị là 11,0 tháng; 95% CI (9,6; 12,4).
Tỷ lệ đáp ứng khách quan theo BICR đã được ghi nhận là trên 50% ở tất cả các phân nhóm phân tích được xác định trước, bao gồm các liệu pháp điều trị, chủng tộc, tuổi tác và khu vực.
Khi đánh giá đáp ứng trên toàn bộ dân số, 85% (223/262) được ghi nhận là có đáp ứng tại thời điểm rà soát đầu tiên (6 tuần); 94% (247/262) ghi nhận dữ liệu đáp ứng tại thời điểm rà soát thứ hai (12 tuần).
Dữ liệu hiệu quả trên bệnh nhân di căn CNS trong các nghiên cứu pha 2 (AURAex và AURA2)
Đánh giá của BICR về hiệu quả CNS theo tiêu chuẩn RECIST v 1.1 đã được thực hiện trong một phân nhóm gồm 50 bệnh nhân (trong tổng số 411 bệnh nhân) được xác định có di căn CNS đo được trên hình ảnh scan não. Tỷ lệ đáp ứng khách quan (ORR) trên CNS là 54% (27/50 bệnh nhân; 95% CI: 39,3; 68,2) được quan sát, trong đó có 12% đáp ứng hoàn toàn.
Các nghiên cứu lâm sàng đã không được tiến hành đối với bệnh nhân NSCLC có đột biến EGFR T790M ngay từ đầu (de novo EGFR T790M).
Trẻ em: Tính an toàn và hiệu quả của Tagrix (Osimertinib) ở trẻ em và trẻ vị thành niên < 18 tuổi chưa được thiết lập. Hiện chưa có dữ liệu.
Đặc tính dược động học
Các tham số dược động học của Tagrix (Osimertinib) được xác lập trên người khỏe mạnh và bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC). Dựa trên phân tích về dược động học trong dân số nghiên cứu, độ thanh thải huyết tương biểu kiến của Tagrix (Osimertinib) 14,2 L/giờ, thể tích phân bố biểu kiến là 997 L và thời gian bán thải pha cuối khoảng 48 giờ. AUC và Cmax tăng tỷ lệ theo liều ở mức liều từ 20 đên 240 mg. Khi dùng Tagrix (Osimertinib) ngày 1 lần làm tăng tích lũy khoảng 3 lần với mức tiếp xúc hằng định đạt được sau 15 ngày dùng thuốc. Ở trạng thái hằng định, nồng độ thuốc trong huyết tương tuần hoàn duy trì một cách điển hình ở mức gấp 1,6 lần trong khoàng 24 giờ dùng thuốc.
Hấp thu:
Sau khi dùng Tagrix (Osimertinib) đường uống, nồng độ đỉnh của Tagrix (Osimertinib) trong huyết tương đạt được ở khoảng thời gian tmax trung vị (min-max) là 6 giờ (3-24 giờ), với một vài đỉnh đã được ghi nhận trong 24 giờ đầu tiên trên một số bệnh nhân. Độ sinh khả dụng tuyệt đối của Tagrix (Osimertinib) chưa được xác định. Dựa trên một nghiên cứu dược động học lâm sàng trên bệnh nhân tại mức liều 80 mg, thức ăn không làm thay đổi sinh khả dụng Tagrix (Osimertinib) đến một mức độ có ý nghĩa lâm sàng. (AUC tăng 6% (90% CI -5, 19) và Cmax giảm 7% (90% CI -19, 6)). Ở người tình nguyện khỏe mạnh dùng 1 viên 80 mg mà pH dạ dày đã được nâng lên do dùng liều omeprazole trong 5 ngày, nồng độ và thời gian tiếp xúc của Tagrix (Osimertinib) đã không bị ảnh hưởng (AUC và Cmax tăng tương ứng là 7% và 2%) với 90% CI về tỷ lệ tiếp xúc nằm trong giới hạn 80-125%.
Phân bố:
Thể tích phân bố trung vị ước tính trên dân số nghiên cứu của Tagrix (Osimertinib) ở trạng thái hằng định (Vss/F) là 997 L cho thấy thuốc phân phối rộng rãi vào các mô. Không thể đo mức gắn kết protein trong huyết tương vì không ổn định, tuy nhiên theo các đặc tính lý hóa của Tagrix (Osimertinib), mức gắn kết với protein huyết tương có lẽ là rất cao. Tagrix (Osimertinib) cũng đã được chứng tỏ gắn kết tương đương với protein huyết tương ở chuột và ở người, albumin huyết thanh của người và chuột và tế bào gan người.
Biến đổi sinh học
Nghiên cứu in vitro cho thấy Tagrix (Osimertinib) được chuyển hóa chủ yếu bởi CYP3A4 và CYP3A5. Quá trình chuyển hóa qua CYP3A4 có thể là đường chuyển hóa phụ. Đường chuyển hóa thay thế có thể tồn tại nhưng chưa được mô tả đầy đủ. Dựa trên các nghiên cứu trong ống nghiệm in vitro, 2 chất chuyển hóa có hoạt tính dược lý (AZ7550 và AZ5104) sau đó đã được xác định trong huyết tương trong nghiên cứu tiền lâm sàng và ở người sau một liều uống với Tagrix (Osimertinib); AZ7550 cho thấy dược lực tương tự với Tagrix (Osimertinib) trong khi AZ5104 cho thấy hiệu quả mạnh hơn trên EGFR ở cả hai thể đột biến và không đột biến (type wide). Cả hai chất chuyển hóa xuất hiện từ từ trong huyết tương sau khi bệnh nhân uống Tagrix (Osimertinib), với tmax bình quân (min-max) đối với các chất chuyển hóa AZ7550 và AZ5104 tương ứng là 24 giờ (4-72 giờ) và 24 giờ (6-72 giờ). Trong huyết tương người, Tagrix (Osimertinib) chiếm 0,8%, với 2 chất chuyển hóa phân bố là 0,08% và 0,07% tổng số phóng xạ với phần lớn các chất phóng xạ gắn kết tương đương với protein huyết tương. Việc tiếp xúc trung bình hình học của cả hai AZ5104 và AZ7550, dựa trên AUC, xấp xỉ 10% mức tiếp xúc của Tagrix (Osimertinib) khi ở trạng thái ổn định.
Đường chuyển hóa chính của Tagrix (Osimertinib) là qua oxy hóa và khử alkyl hóa. Có ít nhất 12 thành phần đã được quan sát thấy trong nước tiểu gộp và mẫu phân ở người với 5 thành phần chiếm > 1% liều mà trong đó Tagrix (Osimertinib) dạng không đổi, AZ5104 và AZ7550, chiếm khoảng 1,9; 6,6 và 2,7% liều trong khi sản phẩm cộng cysteinyl khép (M21) và một chất chuyển hóa chưa rõ (M25) chiếm tỷ lệ tương ứng là 1,5% và 1,9% liều.
Dựa trên các nghiên cứu in vitro, Tagrix (Osimertinib) là một chất ức chế cạnh tranh của CYP 3A4/5 nhưng không ức chế CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6 và 2E1 ở các nồng độ có liên quan về mặt lâm sàng. Dựa trên các nghiên cứu in vitro, Tagrix (Osimertinib) không phải là một chất ức chế UGT1A1 và UGT2B7 ở nồng độ lâm sàng có liên quan đến gan. UGT1A1 có thể gây ra ức chế trên ruột nhưng tác động lâm sàng chưa được biết.
Thải trừ:
Sau khi uống một liều duy nhất 20 mg, 67,8% liều đã được phát hiện trong phân (1,2% ở dạng không đổi), trong khi 14,2% liều dùng (0,8% ở dạng không đổi) đã được tìm thấy trong nước tiểu sau 84 ngày kể từ ngày thu mẫu. Tagrix (Osimertinib) không đổi chiếm khoảng 2% của quá trình thải trừ với 0,8% trong nước tiểu và 1,2% trong phân.
Tương tác với protein vận chuyển:
Các nghiên cứu in vitro cho thấy Tagrix (Osimertinib) không phải là chất nền của OATP1B1 và OATP1B3. In vitro, Tagrix (Osimertinib) không ức chế OAT1, OAT3, OATP1B1, OATP1B3 và MATE2K ở các nồng độ có liên quan về lâm sàng. Tuy nhiên, không thể loại trừ tương tác với chất nền MATE1 và OCT2.
Tác động của osimertinib trên P-gp và BCRP:
Dựa trên các nghiên cứu in vitro, Tagrix (Osimertinib) là một chất nền của P-glycoprotein và protein kháng ung thư vú (BCRP), nhưng có lẽ không gây tương tác thuốc trên lâm sàng với các thuốc khác do Tagrix (Osimertinib) tại các mức liều lâm sàng. Dựa trên dữ liệu in vitro, Tagrix (Osimertinib) là một chất ức chế BCRP và P-gp. Chưa nghiên cứu các tương tác điều biến qua men PXR khác với CYP3A4 (xem phần ''Tương tác'').
Trên các nhóm dân số đặc biệt:
Trong một phân tích dược động học trên dân số nghiên cứu (n=1088), không xác định mối liên hệ có ý nghĩa lâm sàng giữa mức tiếp xúc ở trạng thái hằng định được dự đoán (AUCss) và tuổi tác của bệnh nhân (25-91 tuổi), giới tính (nữ 65%), chủng tộc (bao gồm da trắng, chủng tộc châu Á, Nhật Bản, Trung Quốc và bệnh nhân không phải da trắng và không thuộc chủng tộc châu Á) và tình trạng hút thuốc (người hiện tại hút thuốc n=27, người từng hút thuốc n=329). Phân tích dược động học trên dân số nghiên cứu cho thấy trọng lượng cơ thể là một biến độc lập (covariate) đáng kể với AUCss Tagrix (Osimertinib) dự kiến theo trọng lượng cơ thể từ 89kg đến 43kg (điểm phân vị (quantiles) 95% đến 5%) đã thay đổi ít hơn 20% khi so sánh với các AUCss theo trọng lượng cơ thể trung vị là 60kg. Xem xét các điểm từ nhỏ nhất đến cao nhất của trọng lượng cơ thể (từ < 43kg đến > 89kg), tỷ lệ chất chuyển hóa AZ5104 dao động từ 11,8% xuống còn 9,6% trong khi đối với AZ7550, tỷ lệ này dao động tương ứng từ 12,8% xuống còn 8,1%. Dựa trên một phân tích dược động học dân số, albumin huyết thanh được xác định là một biến độc lập (covariate) đáng kể với AUCss Tagrix (Osimertinib) dự kiến thay đổi từ -15% đến +30% theo mức albumin tương ứng từ 29 đến 46 g/L (điểm phân vị (quantiles) 95% đến 5%) khi so sánh với AUCss ở mức albumin trung vị căn bản 39 g/L. Những thay đổi về mức tiếp xúc này do trọng lượng cơ thể hoặc sự khác biệt albumin cơ bản không được xem là có liên quan về lâm sàng.
Bệnh nhân suy giảm chức năng gan:
Tagrix (Osimertinib) được thải trừ chủ yếu qua gan, và do đó, bệnh nhân suy gan có thể tăng mức tiếp xúc. Chưa được tiến hành thử nghiệm dược động học trên người suy gan. Dựa trên phân tích dược động học dân số, không có mối quan hệ giữa các dấu chỉ của chức năng gan (ALT, AST, bilirubin) và mức tiếp xúc Tagrix (Osimertinib). Các dấu chỉ của chức năng gan (albumin huyết thanh) cho thấy có tác động trên dược động học của Tagrix (Osimertinib). Các nghiên cứu lâm sàng được thực hiện đã loại trừ bệnh nhân có AST hoặc ALT > 2,5 lần giới hạn trên của bình thường (ULN), hoặc nếu do bệnh ác tính tiềm ẩn, đã loại trừ bệnh nhân có AST hoặc ALT > 5,0xULN hoặc với bilirubin toàn phần > 1,5xULN. Dựa trên phân tích dược động học của 104 bệnh nhân suy gan nhẹ, 8 bệnh nhân suy gan trung bình và 972 bệnh nhân có chức năng gan bình thường, mức Tagrix (Osimertinib) là tương tự nhau. Có ít dữ liệu có sẵn trên bệnh nhân suy gan nặng (xem phần ''Liều lượng và Cách dùng'').
Bệnh nhân suy giảm chức năng thận:
Chưa tiến hành nghiên cứu dược động học trên bệnh nhân suy thận. Dựa trên phân tích dược động dân số của 471 bệnh nhân suy thận nhẹ (CLcr 60 đến < 90mL/phút), 208 bệnh nhân suy thận vừa (CLcr 30 đến < 60mL/phút), 5 bệnh nhân suy thận nặng (CLcr 15 đến < 30mL/phút) và 402 bệnh nhân có chức năng thận bình thường (lớn hơn hoặc bằng 90mL/phút), mức tiếp xúc Tagrix (Osimertinib) là tương tự nhau. Tình trạng suy thận nặng có thể ảnh hưởng đến thải trừ các thuốc thải trừ qua đường thận. Các thử nghiệm lâm sàng này không bao gồm bệnh nhân có CLcr < 15mL/phút.
Điều chỉnh liều
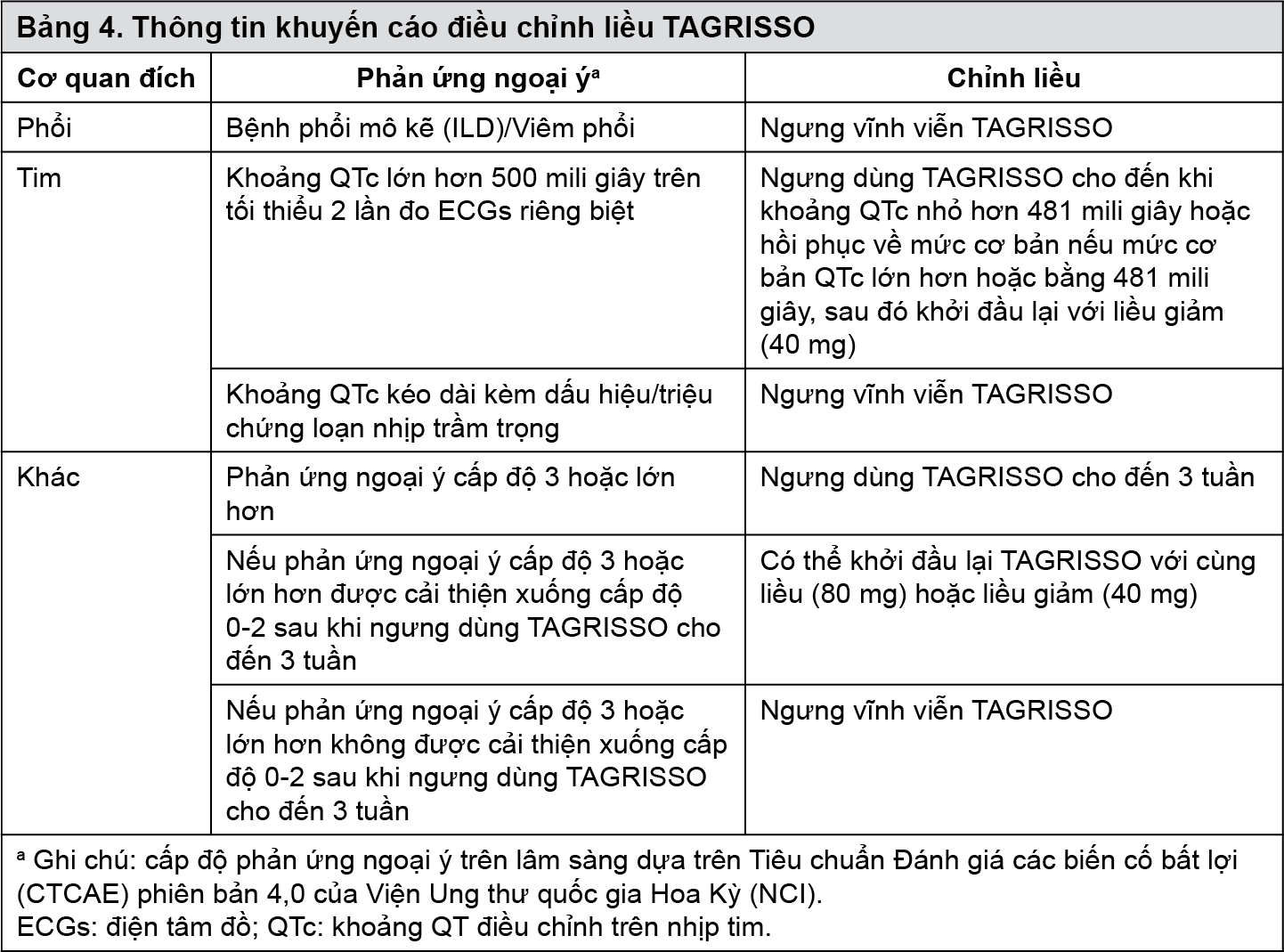
Có thể cần ngưng liều và/hoặc điều chỉnh liều dựa trên mức độ an toàn và dung nạp của mỗi cá nhân. Nếu cần giảm liều, nên giảm xuống liều 40 mg, 1 lần/ngày. Hướng dẫn giảm liều khi gặp độc tính phản ứng ngoại ý được trình bày trong Bảng 4.
Bảng 4.
Các nhóm bệnh nhân đặc biệt: Không cần chỉnh liều do tuổi, cân nặng, giới tính, chủng tộc hoặc tình trạng hút thuốc của bệnh nhân (xem phần “Đặc tính dược động”).
Bệnh nhân suy gan: Không có các nghiên cứu lâm sàng được tiến hành để đánh giá đặc biệt tác động của tình trạng suy gan trên dược động học của Tagrix (Osimertinib). Không cần điều chỉnh liều ở bệnh nhân suy gan nhẹ (tổng bilirubin ≤ giới hạn trên của mức bình thường (ULN) và men aspartate aminotransferase (AST) >ULN hoặc tổng bilirubin >1,0 đến 1,5xULN và xuất hiện AST) hoặc ở bệnh nhân suy gan trung bình (tổng bilirubin từ 1,5 đến 3 lần ULN và có xuất hiện AST). Tuy nhiên thận trọng khi dùng Tagrix (Osimertinib) cho các bệnh nhân này. Hiệu quả và tính an toàn của thuốc chưa được thiết lập trên bệnh nhân suy gan nặng. Cho đến khi có dữ liệu mới, không khuyến cáo dùng trên bệnh nhân suy gan nặng (xem phần “Đặc tính dược động”).
Bệnh nhân suy thận: Không có các nghiên cứu lâm sàng được tiến hành để đánh giá đặc biệt tác động của tình trạng suy thận trên dược động học của Tagrix (Osimertinib). Không cần chỉnh liều ở bệnh nhân suy thận nhẹ, trung bình hoặc nặng. Ít dữ liệu có sẵn trên bệnh nhân suy thận nặng. Tính an toàn và hiệu quả của thuốc chưa được thiết lập ở bệnh nhân bệnh thận giai đoạn cuối [độ thanh thải creatinin (CLcr) < 15mL/phút được tính theo công thức Cockcroft and Gault] hoặc đang lọc máu. Nên thận trọng khi điều trị cho bệnh nhân suy thận nặng và bệnh thận giai đoạn cuối (xem phần “Đặc tính dược động”).
Trẻ em: Tính an toàn và hiệu quả của Tagrix (Osimertinib) ở trẻ em và trẻ vị thành niên < 18 tuổi chưa được thiết lập. Hiện chưa có dữ liệu.
Cảnh báo: Đánh giá tình trạng đột biến EGFR T790M
Khi xem xét dùng Tagrix (Osimertinib) để điều trị cho bệnh nhân ung thư phổi loại không phải tế bào nhỏ (NSCLC) giai đoạn tiến triển tại chỗ hoặc di căn, việc xác định tình trạng đột biến EGFR T790M là rất quan trọng. Nên thực hiện một xét nghiệm đã được công nhận bằng cách sử dụng mẫu DNA khối u lấy từ mẫu mô hoặc mẫu DNA khối u trong hệ tuần hoàn (ctDNA) thu thập từ mẫu huyết tương.
Chỉ dùng các phương pháp xét nghiệm có độ tái lập, độ tin cậy, độ nhạy cùng với các chương trình tiện ích (utility) đã được kiểm chứng để xác định tình trạng đột biến T790M của mẫu DNA khối u (từ mẫu mô hoặc mẫu huyết tương).
Việc xác định tình trạng dương tính của đột biến T790M sử dụng xét nghiệm trên mẫu mô hoặc mẫu huyết tương sẽ cho biết có đủ điều kiện điều trị với Tagrix (Osimertinib). Tuy nhiên, nếu sử dụng xét nghiệm mẫu DNA khối u trong hệ tuần hoàn dựa trên mẫu huyết tương và có kết quả âm tính, khuyến cáo nên theo dõi tiếp bằng xét nghiệm từ mẫu mô nếu có thể vì có khả năng xét nghiệm mẫu huyết tương cho kết quả âm tính giả.
Bệnh phổi mô kẽ (ILD)
Bệnh phổi mô kẽ (ILD) trầm trọng/đe dọa đến tính mạng/gây tử vong hoặc phản ứng ngoại ý giống ILD (như viêm phổi) đã được ghi nhận ở bệnh nhân dùng Tagrix (Osimertinib) trong các nghiên cứu lâm sàng. Hầu hết các trường hợp được cải thiện hoặc biến mất khi ngưng điều trị. Bệnh nhân có tiền sử ILD trước đây, đã dùng thuốc gây ILD, viêm phổi do xạ trị mà yêu cầu dùng steroid hoặc có bất kỳ bằng chứng ILD tiến triển trên lâm sàng đã được loại trừ khỏi các nghiên cứu lâm sàng này (xem phần “Tác dụng ngoại ý”).
Đã ghi nhận bệnh phổi mô kẽ (ILD) hoặc phản ứng ngoại ý giống ILD (như viêm phổi) ở 3,5% bệnh nhân và tử vong ở 0,6% trên tổng số 833 bệnh nhân dùng Tagrix (Osimertinib) trong các nghiên cứu AURA. Tần xuất xảy ra ILD là 8,2% ở bệnh nhân là người Nhật bản, 1,9% ở bệnh nhân Châu Á và 2,9% ở nhóm bệnh nhân không thuộc chủng tộc Châu Á (xem phần “Tác dụng ngoại ý”).
Cần đánh giá thận trọng để loại trừ ILD đối với tất cả bệnh nhân khởi phát cấp tính triệu chứng đường hô hấp (khó thở, ho, sốt) và/hoặc các triệu chứng này trở nên nặng hơn không giải thích được. Nên ngưng điều trị bằng thuốc này trong khi đang kiểm tra các triệu chứng trên. Nếu đã chẩn đoán là ILD, nên ngưng vĩnh viễn Tagrix (Osimertinib) và bắt đầu các liệu pháp điều trị cần thiết.
Kéo dài khoảng QTc
Khoảng QTc kéo dài xuất hiện trên bệnh nhân dùng Tagrix (Osimertinib) và có thể dẫn đến tăng nguy cơ nhịp nhanh thất (như xoắn đỉnh) hoặc tử vong đột ngột. Không có biến cố loạn nhịp nào được ghi nhận trong các nghiên cứu AURAex or AURA2 (xem phần “Tác dụng ngoại ý”). Bệnh nhân có bất thường về nhịp và dẫn truyền nặng trên lâm sàng khi đo điện tâm đồ lúc nghỉ (ECG) (như là khoảng QTc lớn hơn 470 mili giây) đã được loại trừ trong các nghiên cứu này (xem phần “Tác dụng ngoại ý”).
Khi có thể, nên tránh dùng Tagrix (Osimertinib) trên bệnh nhân có hội chứng QT kéo dài bẩm sinh. Nên theo dõi định kỳ điện tâm đồ (ECGs) và chất điện giải trên bệnh nhân suy tim sung huyết, rối loạn điện giải hoặc ở bệnh nhân đang dùng thuốc đã biết làm kéo dài khoảng QTc. Nên ngưng điều trị ở bệnh nhân có khoảng QTc lớn hơn 500 mili giây được ghi nhận trên ít nhất 2 lần đo điện tâm đồ tách biệt cho đến khi khoảng QTc nhỏ hơn 481 mili giây hoặc phục hồi về trị số căn bản nếu khoảng QTc lớn hơn hoặc bằng 481 mili giây, sau đó có thể dùng lại Tagrix (Osimertinib) ở mức liều giảm như trình bày tại Bảng 4. Nên ngưng Tagrix (Osimertinib) vĩnh viễn ở bệnh nhân có khoảng QTc kéo dài đi kèm với các biến cố sau: Xoắn đỉnh, nhịp nhanh thất đa dạng, có dấu hiệu/ triệu chứng loạn nhịp trầm trọng.
Thay đổi tính co thắt cơ tim:
Trong các nghiên cứu lâm sàng, phân suất tống máu thất trái (Left Ventricular Ejection Fraction - LVEF) giảm ≥ 10% và một sự sụt giảm < 50% đã xảy ra trong 4,0% (26/655) bệnh nhân dùng Tagrix (Osimertinib), là những người có đánh giá LVEF khi khởi đầu điều trị và tối thiểu 1 lần theo dõi sau đó. Qua các dữ liệu lâm sàng có sẵn, mối liên hệ nhân quả giữa tác động trên co thắt cơ tim và Tagrix (Osimertinib) chưa được thiết lập. Trên bệnh nhân có các yếu tố nguy cơ trên tim và những người có các tình trạng có thể ảnh hưởng đến LVEF, nên xem xét theo dõi tim, bao gồm đánh giá LVEF khi khởi đầu (at baseline) và trong khi điều trị. Trên bệnh nhân có dấu hiệu/triệu chứng tim liên quan trong khi điều trị, việc theo dõi tim bao gồm đánh giá LVEF nên được xem xét.
Viêm giác mạc:
Viêm giác mạc đã được ghi nhận ở 0,7% (n=6) trên tổng số 833 bệnh nhân điều trị bằng Tagrix (Osimertinib) trong các nghiên cứu AURA. Nên thăm khám bác sỹ chuyên khoa mắt ngay lập tực khi bệnh nhân có các dấu hiệu và triệu chứng nghi ngờ viêm kết mạc như tình trạng cấp hoặc trầm trọng hơn của viêm mắt, chảy nước mắt, nhạy cảm ánh sáng, mờ mắt, đau mắt và/hoặc mắt đỏ (xem phần “Liều lượng và Cách dùng” - Bảng 4).
Ảnh hưởng trên khả năng lái xe và vận hành máy móc: Tagrix (Osimertinib) không có hoặc ít ảnh hưởng đến việc lái xe hoặc vận hành máy móc.
Trong các nghiên cứu lâm sàng đã có một số ít bệnh nhân dùng Tagrix (Osimertinib) liều hàng ngày lên đến 240 mg mà không ghi nhận độc tính giới hạn liều (dose limiting toxicities). Trên các nghiên cứu này, bệnh nhân dùng Tagrix (Osimertinib) với liều hàng ngày 160 mg và 240 mg đã ghi nhận có sự tăng tần suất và mức độ trầm trọng các phản ứng ngoại ý điển hình gây ra do EGFR TKI (chủ yếu là tiêu chảy và nổi mẩn da) so với mức liều 80 mg. Rất ít kinh nghiệm về quá liều ngẫu nhiên trên người. Tất cả các trường hợp đều xảy ra riêng lẻ là do bệnh nhân sai sót khi dùng thuốc mà không gặp bất kỳ hậu quả lâm sàng nào. Không có xử trí đặc biệt trong trường hợp quá liều Tagrix (Osimertinib). Khi nghi ngờ quá liều, nên ngưng dùng Tagrix (Osimertinib) và bắt đầu xử trí triệu chứng.
Sử dụng ở phụ nữ có thai và cho con bú:
Biện pháp ngừa thai đối với nam giới và phụ nữ: Phụ nữ có khả năng mang thai được khuyến cáo nên tránh có thai khi dùng Tagrix (Osimertinib). Bệnh nhân nên dùng các biện pháp ngừa thai hiệu quả tối thiểu là 2 tháng ở phụ nữ và 4 tháng ở nam giới sau khi hoàn tất liệu trình điều trị bằng thuốc. Không loại trừ nguy cơ thuốc làm giảm nồng độ và thời gian tiếp xúc của hormon ngừa thai.
Phụ nữ có thai: Chưa có hoặc ít dữ liệu về việc dùng Tagrix (Osimertinib) cho phụ nữ có thai. Các nghiên cứu trên động vật cho thấy thuốc gây độc tính trên hệ sinh sản (gây chết phôi thai, giảm phát triển phôi thai và tử vong chu sinh). Theo cơ chế tác động và dữ liệu tiền lâm sàng, Tagrix (Osimertinib) có thể làm tổn hại phôi thai khi dùng thuốc trên phụ nữ có thai. Tagrix (Osimertinib) không nên dùng cho phụ nữ có thai trừ phi tình trạng lâm sàng của bệnh nhân này bắt buộc phải điều trị với Tagrix (Osimertinib).
Phụ nữ đang cho con bú: Chưa biết rõ liệu Tagrix (Osimertinib) hoặc chất chuyển hóa có bài tiết qua sữa mẹ hay không. Không có thông tin đầy đủ về việc bài tiết Tagrix (Osimertinib) hoặc chất chuyển hóa vào sữa trên động vật. Tuy nhiên, Tagrix (Osimertinib) và các chất chuyển hóa đã được phát hiện trên lứa chó con đang bú và đã ghi nhận có phản ứng ngoại ý trên sự phát triển và sống còn của lứa chó con này. Chưa loại trừ nguy cơ trên trẻ em đang bú nếu người mẹ dùng thuốc. Nên ngưng cho con bú khi người mẹ dùng thuốc Tagrix (Osimertinib).
Khả năng sinh sản: Chưa có dữ liệu về ảnh hưởng của Tagrix (Osimertinib) trên khả năng sinh sản ở người. Kết quả từ các nghiên cứu trên súc vật cho thấy osimertinib có ảnh hưởng trên các cơ quan sinh sản của nam giới/phụ nữ và có thể gây tổn hại khả năng sinh sản.
Tương tác thuốc:
( tương tác của thuốc xin đọc ở phần này)
Mua thuốc Tagrix 80mg ở đâu? |
|
Để mọi bệnh nhân được dùng đúng thuốc với giá tốt Ths, Bs: LÊ VĂN CHÍNH Liên hệ SĐT: 0936.297.258 Đảm bảo tư vấn tận tình, hàng chính hãng với giá tốt nhất! Chúng tôi cung ứng thuốc toàn quốc! Lào Cai, Yên Bái, Điện Biên, Hòa Bình, Lai Châu, Hà Giang, Cao Bằng, Bắc Kạn, Lạng Sơn, Tuyên Quang, Thái Nguyên, Phú Thọ, Bắc Giang, Quảng Ninh, Bắc Ninh, Hà Nam, Hải Dương, Hưng Yên, Hải Phòng, Nam Định, Ninh Bình, Thái Bình, Vĩnh Phúc. Thanh Hóa, Nghệ An, Quảng Bình, Quảng Trị, Thừa Thiên Huế, Đà Nẵng, Quảng Nam, Quảng Ngãi, Bình Định, Phú Yên, Khánh Hòa, Ninh Thuận, Bình Thuận, Kon Tum, Gia Lai, Đắc Lắk, Đắc Nông, Lâm Đồng. Đồng Nai, Bà Rịa - Vũng Tàu, Bình Dương, Bình Phước, Tây Ninh, Cần Thơ, Long An, Tiền Giang, Bến Tre, Vĩnh Long, Trà Vinh, Đồng Tháp, An Giang, Kiên Giang, Hậu Giang, Sóc Trăng, Bạc Liêu, Cà Mau. Thuốc có sẵn tại Hà Nội và TP. Hồ Chí Minh. Tại các tỉnh và thành phố khác, giao hàng chuyển phát nhanh qua đường bưu điện. |
Thuốc Sorafenat 200mg
Tên Thuốc: Sorafenat 200mg Thành phần: Sorafenib 200mg Viên nén: Hoạt chất Sorafenib 200 mg Quy cách đóng gói: Hộp 120 viên Nhà sản xuất: Natco Pharma Xuất xứ: Ấn Độ
Thuốc Geftinat 250mg
1.400.000đ
Thuốc điều trị ung thư phổi Geftinat Tên thương mại: Geftinat 250mg Thành phần: Gefitinib Hàm lượng: 250mg Dạng: Viên nén Đóng gói: Hộp dạng vỉ 30 viên Nhà phân phối: NATCO PHARMA LIMITED - Ấn Độ
Thuốc Erlonat 150mg
2.000.000đ
- Tên thuốc: Erlonat 150mg - Nhà sản xuất: NATCO PHARMA LIMITED - Xuất xứ: India - Thành phần: Erlotinib 150mg (Biệt dược của Erlotinib như: Erlonat; Erlocip; Erlotib, Tarceva; Zyceva ...) - Dạng bào chế: Viên nén 150mg - Đóng gói: Hộp dạng vỉ 30 viên
Thuốc Osicent 80mg
Tên thương mại: Osicent 80mg Thành phần: Osimertinib Hàm lượng: 80mg Dạng: Viên nén Đóng gói: Hộp giấy chứa lọ 30 viên Nhà phân phối: Incepta Pharmaceuticals Ltd., Xuất xứ: Bangladesh Thuốc Osicent mua ở đâu giá rẻ nhất và uy tín nhất? Chúng tôi là đơn vị cung cấp thuốc Osicent 80mg chính hãng trên toàn quốc. Hãy gọi 0966.58.1290
Thuốc Osimert 80mg
Tên Thuốc: Osimert 80mg Thành phần: Osimertinib 80mg (dạng viên nén) Hộp: 30 viên nén Nhà sản xuất: Everest Pharmaceuticals Ltd., Xuất xứ: Bangladesh
Thuốc Hepbest 25mg
500.000đ
Tên thuốc: HepBest 25mg Thành phần, hàm lượng: Mỗi viên nén bao phim có chứa Tenofovir Alafenamide 25 mg Dạng bào chế: Viên nén bao phim; hình thuôn dài màu trắng hoặc ngà trắng có khắc chữ M ở một mặt và chữ TFI ở mặt còn lại. Đóng gói: Hộp 30 viên. Nhà sản xuất: Mylan Laboratories Limited Xuất xứ: Ấn Độ
Thuốc Alecensa 150mg
Hãng sản xuất: Roche Tên thương mại: Alecensa 150mg Thành phần: Alectinib 150mg Hàm lượng: 150mg Dạng: Viên nhộng Đóng gói: Hộp 224 viên bên trong chứa 4 hộp nhỏ 56 viên Nhà phân phối: Roche - Thổ Nhĩ Kỳ
Thuốc Crizonix 250mg
- Tên thương hiệu: Crizonix 250mg - Thành phần: Crizotinib 250mg - Hàm lượng: 250mg - Dạng: Viên con nhộng - Đóng gói: Hộp 60 viên - Nhà sản xuất: Beacon Pharmaceuticals Limited... - Xuất sứ: Bangladesh.
Thuốc IRESSA 250 mg
Tên thương mại: IRESSA 250mg Thành phần: Gefitinib Dạng: Viên nén bao phim Nhà sản xuất: AstraZeneca
Thuốc Nexavar 200mg
Tên thuốc: Nexavar 200mg Thành phần: Sorafenib 200mg Viên nén: 200 mg
Thuốc Afanix 40mg
Tên thuốc: Afanix 40mg Thành phần: Afatinib 40mg Viên nén: 40mg Đóng gói hộp: 30 viên (đủ dùng cho 1 tháng điều trị) Nhà sản xuất: BEACON Pharmaceuticals Limited Xuất xứ: Bangladesh
Thuốc Luciosim 80mg
Tên thuốc: LUCIOSIM 80mg Thành phần: Osimertinib 80mg Osimertinib có các biệt dược như: Luciosim, Osimert, Tagrix, Tagrisso, Osicent.... Viên nén: 80mg Đóng gói lọ/hũ: 30 viên (Đủ dùng điều trị 1 tháng) Nhà sản xuất: LUCIUS pharmaceuticals. Xuất xứ: Colombo
Thuốc Noxalk 150mg
Thành phần: Ceritinib 150mg Viên nang: 150 mg Nhà sản xuất: NATCO PHARMA LIMITED Xuất xứ: India Đóng gói: 30 viên/Hộp
Thuốc Tarceva 150mg
Nhà chế tạo: Roche Thành phần: Erlotinib 150mg
Thuốc Tykerb 250mg
Tên thuốc: Tykerb 250mg Thành phần: Lapatinib Viên nén: 250mg
Thuốc Xbira (Abirateron) 250mg
Thành phần: Abirateron acetat 250mg. Đóng gói: Hộp 1 lọ 120 viên nén. Nhà sản xuất: Công ty Dược phẩm Cipla. Xuất xứ: Ấn Độ.
Thuốc Cabozanix/Cabozatinib
Tên thuốc: Cabozanix Thành phần: Cabozantinib Đóng gói: 30 viên/hộp Xuất xứ: Bangladesh
Thuốc Kadcyla
- Tên thuốc: Kadcyla -Thành phần: Trastuzumab emtansine - Mỗi lọ: Trastuzumab emtansin 100mg hoặc 160mg
Thuốc Avastin
Tên thuốc: Avastin Thành phần: Avastin (bevacizumab)
Okinawa Fucoidan Kanehide Bio 180 viên (Fucoidan-xanh)
1.500.000đ
- Tên sản phẩm: Okinawa Fucoidan Kanehide Bio - Hàm lượng: 295 mg/viên - Mỗi viên chứa: 235 mg Fucoidan nguyên chất - Nhà sản xuất: Kanehide Biotechnology Co., Ltd. - Xuất xứ: Okinawa - Nhật Bản - Đóng gói: 180 viên/Lọ - Dạng bào chế: Viên nang


























Xem thêm