Libtayo (Cemiplimab-rwlc) điều trị Ung thư phổi - Nâng cao
Libtayo (Cemiplimab-rwlc) điều trị Ung thư phổi - Nâng cao
|
|
|
26 tháng 2 năm 2021
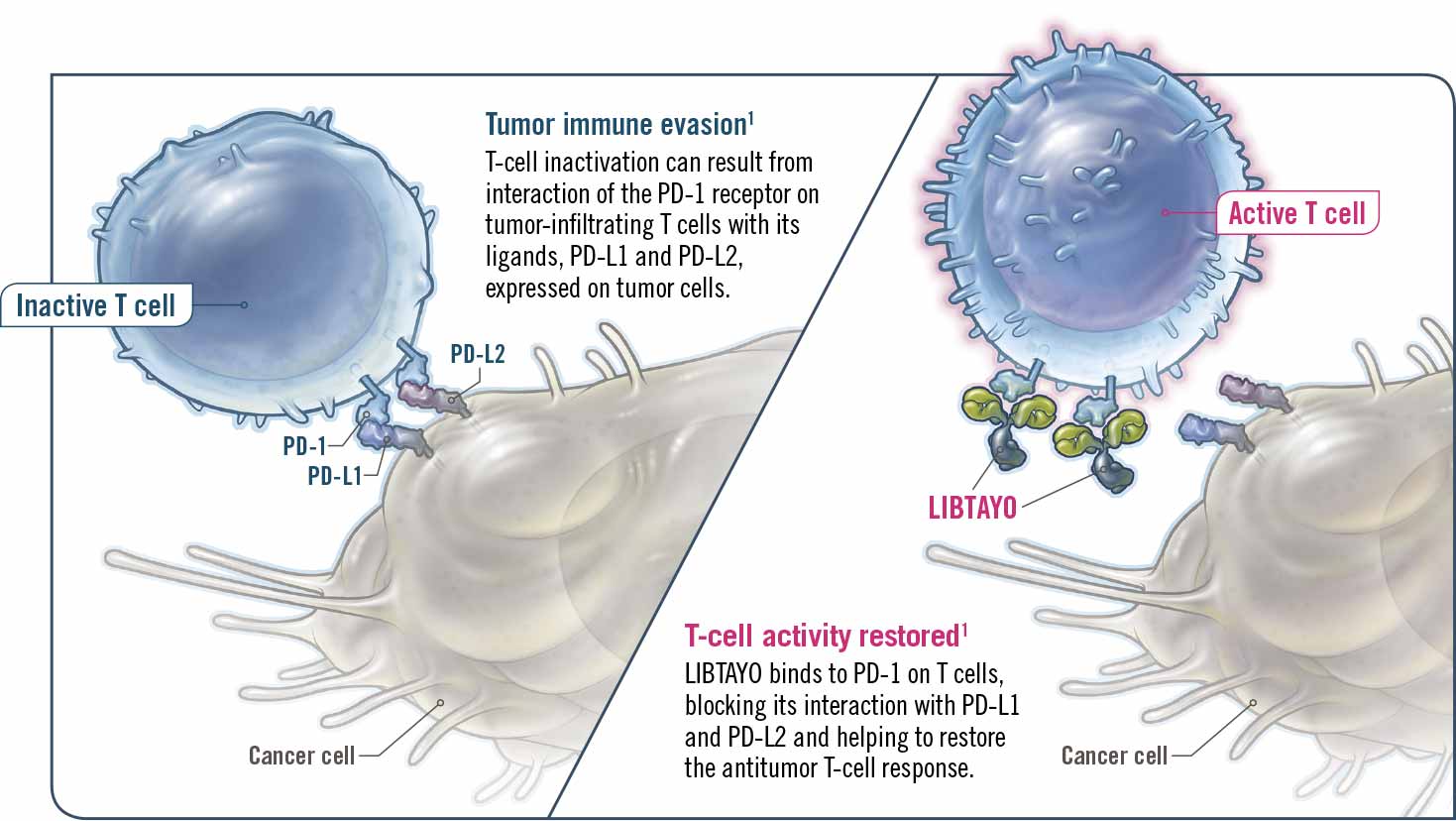
Ngày 22 tháng 2 năm 2021, Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt chất ức chế PD-1 Libtayo® (cemiplimab-rwlc) để điều trị đầu tay cho bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn cuối (NSCLC) có khối u có biểu hiện PD-L1 cao (tỷ lệ khối u ≥50%), được xác định bằng xét nghiệm được FDA chấp thuận. Bệnh nhân phải có khối u di căn hoặc tiến triển tại chỗ không phải là đối tượng để phẫu thuật cắt bỏ hoặc hóa xạ trị dứt điểm và khối u không được có sai lệch EGFR, ALK hoặc ROS1.
Theo Sanofi, nhà sản xuất PD-1, FDA đã phê duyệt đơn trị liệu bước đầu Libtayo (cemiplimab-rwlc) là chất ức chế PD-L1 để điều trị bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) giai đoạn muộn với biểu hiện PD-L1 từ 50% trở lên.
Để đủ điều kiện điều trị bằng Libtayo (cemiplimab-rwlc), bệnh nhân không chỉ phải có biểu hiện PD-L1 cao trong khối u của họ, được xác định bằng xét nghiệm được FDA chấp thuận, mà còn phải có khối u di căn hoặc tiến triển tại chỗ không đủ điều kiện để phẫu thuật cắt bỏ hoặc hóa trị dứt điểm. Hơn nữa, những bệnh nhân này bị NSCLC không có các đột biến EGFR, ALK hoặc ROS1.
Naiyer Rizvi, MD, Giáo sư Y khoa Price Family, giám đốc khoa ung thư lồng ngực và đồng giám đốc điều trị miễn dịch ung thư tại Đại học Columbia. Trung tâm Y tế Irving, cũng như một thành viên ban chỉ đạo của thử nghiệm, đã nói: “điều đáng chú ý, Libtayo (cemiplimab-rwlc) đã được phê duyệt dựa trên một thử nghiệm quan trọng trong đó hầu hết bệnh nhân hóa trị đều chuyển sang Libtayo (cemiplimab-rwlc) sau sự tiến triển của bệnh và điều đó cho phép những bệnh nhân thường xuyên bị di căn não đã được điều trị và ổn định về mặt lâm sàng, hoặc những người mắc bệnh tiến triển tại chỗ và không phải là ứng viên hóa trị dứt điểm. Điều này cung cấp cho các bác sĩ dữ liệu mới quan trọng khi xem xét Libtayo (cemiplimab-rwlc) cho các bệnh nhân và tình huống khác nhau mà họ điều trị trong thực hành lâm sàng hàng ngày”.
Sự chấp thuận dựa trên những phát hiện từ thử nghiệm EMPOWER-Lung 1 giai đoạn 3, được công bố trên tạp chí The Lancet, bao gồm 356 bệnh nhân đủ điều kiện được dùng cemiplimab-rwlc 3 tuần một lần với liều 350 mg và nhóm chứng gồm 354 bệnh nhân được hóa trị.
Thời gian sống thêm trung bình là 22 tháng ở nhóm Libtayo (cemiplimab-rwlc), so với 14 tháng ở nhóm hóa trị. Ngoài ra, thời gian sống thêm bệnh không có tiến triển, theo đánh giá của Đánh giá Trung ương Độc lập là 6,2 tháng đối với bệnh nhân dùng Libtayo (cemiplimab-rwlc) và 5,6 tháng ở nhóm hóa trị. Hơn 70% bệnh nhân trong thử nghiệm chuyển sang dùng Libtayo (cemiplimab-rwlc) sau khi tiến hành hóa trị. Chất ức chế PD-1 làm giảm 32% nguy cơ tử vong.
Ahmet Sezer, MD, giáo sư tại Khoa Ung thư Y tế tại Đại học Ba inkent ở Adana, Thổ Nhĩ Kỳ và một nhà điều tra thử nghiệm cho biết “Libtayo (cemiplimab-rwlc) đã chứng minh mức độ hiệu quả ấn tượng trong NSCLC nâng cao với ít nhất 50% PD-L1expression trong thử nghiệm quan trọng của nó,” “Như được công bố trên The Lancet, một phân tích xác định trước trong nhóm bệnh nhân được chứng minh có biểu hiện PD-L1 ít nhất 50%, Libtayo (cemiplimab-rwlc) đã giảm nguy cơ tử vong 43% so với hóa trị. Điều này đã đạt được với tỷ lệ chéo hơn 70% so với Libtayo (cemiplimab-rwlc) sau sự tiến triển của bệnh khi điều trị hóa chất, cũng như số lượng bệnh nhân di căn não ổn định trước được điều trị và lâm sàng lớn nhất trong số các thử nghiệm quan trọng NSCLC tiên tiến cho đến nay.
Libtayo (cemiplimab-rwlc) cũng cải thiện kết quả cho những bệnh nhân có khối u có ít hơn 50% PD-L1, giảm nguy cơ tử vong 43% ở nhóm bệnh nhân này so với hóa trị.
Peter C. cho biết: “Với sự chấp thuận lần thứ ba này cho Libtayo (cemiplimab-rwlc), chúng tôi tự hào thực hiện tham vọng mang chất ức chế PD-1 của mình đến những bệnh nhân mắc bệnh ung thư khó điều trị, chẳng hạn như ung thư phổi không phải tế bào nhỏ.
Tài liệu tham khảo:
Sanofi. FDA chấp thuận đơn trị liệu Libtayo® (cemiplimab-rwlc) cho những bệnh nhân bị ung thư phổi không tế bào nhỏ tiến triển bậc một với biểu hiện PD-L1 ≥50%.

Xem thêm