Ung thư phổi không tế bào nhỏ (NSCLC) Có đột biến KRAS G12C
Ung thư phổi không tế bào nhỏ (NSCLC)
Có đột biến KRAS G12C
|
|
|
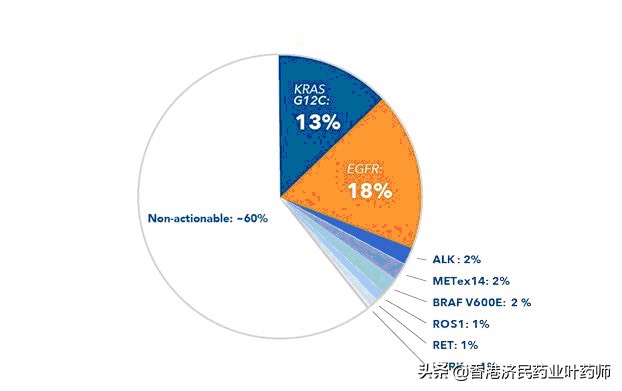
KRAS G12C là một đột biến chiếm khoảng 13% bệnh nhân bị ung thư phổi không tế bào nhỏ (NSCLC).
Ngày 28 tháng 5 năm 2021, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt LUMAKRAS ™ (Sotorasib) để điều trị cho bệnh nhân người lớn mắc bệnh ung thư phổi không tế bào nhỏ (NSCLC) di căn hoặc tiến triển tại chỗ có đột biến KRAS G12C, được xác định bằng một xét nghiệm được FDA chấp thuận, những người đã nhận được ít nhất một điều trị toàn thân trước.
David M. Reese, MD - Phó Chủ tịch điều hành của Nghiên cứu và Phát triển tại Amgen nói: "Sự chấp thuận của FDA đối với LUMAKRAS ™ là một đột phá đối với bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) có đột biến KRAS G12C vì hiện nay đã có một liệu pháp nhắm mục tiêu cho loại đột biến phổ biến này. Chương trình phát triển LUMAKRAS ™ (Sotorasib) là một cuộc chạy đua chống lại bệnh ung thư của Amgen do các nhà khoa học và các nhà điều tra thử nghiệm lâm sàng đã cùng nhau chuyển giao thành công loại thuốc mới này cho bệnh nhân trong vòng 3 năm.
Sự chấp thuận của FDA đối với LUMAKRAS ™ (Sotorasib) dựa trên kết quả từ một nhóm nhỏ bệnh nhân trong CodeBreaK 100, thử nghiệm lâm sàng lớn nhất được tiến hành cho đến nay dành riêng cho những bệnh nhân có đột biến KRAS G12C. Thử nghiệm đã chứng minh hiệu quả và khả năng dung nạp thuận lợi ở 124 bệnh nhân NSCLC có KRAS dương tính với đột biến G12C, người bị bệnh tiến triển sau khi nhận liệu pháp miễn dịch và/hoặc hóa trị. Trong thử nghiệm, 960 mg LUMAKRAS ™ (Sotorasib) dùng đường uống mỗi ngày một lần đã chứng minh ORR (tỷ lệ bệnh nhân có khối u giảm ≥ 30%) là 36% (KTC 95%: 28-45) với 81% (KTC 95%: 73 -87) bệnh nhân đạt được kiểm soát bệnh (tỷ lệ phần trăm bệnh nhân đã đạt được đáp ứng hoàn toàn, đáp ứng một phần và bệnh ổn định trong hơn ba tháng). DoR trung bình là 10 tháng. Các phản ứng có hại thường gặp nhất (≥ 20%) là tiêu chảy, đau cơ xương, buồn nôn, mệt mỏi, nhiễm độc gan và ho. Các phản ứng có hại dẫn đến việc ngừng LUMAKRAS ™ (Sotorasib) vĩnh viễn xảy ra ở 9% bệnh nhân.
LUMAKRAS ™ (Sotorasib) đại diện cho một tiến bộ lớn trong lĩnh vực ung thư học và thay đổi mô hình điều trị cho bệnh nhân ung thư phổi không tế bào nhỏ (NSCL) có đột biến KRAS G12C.
T. Li, MD, Ph.D - điều tra viên chính tại Trung tâm Ung thư Memorial Sloan Kettering nói: "Sotorasib mang đến một lựa chọn mới cho những bệnh nhân mắc ung thư phổi không tế bào nhỏ (NSCL) có đột biến KRAS G12C và đây là liệu pháp nhắm mục tiêu KRAS đầu tiên được được phê duyệt sau gần bốn thập kỷ nghiên cứu".
Ung thư phổi không tế bào nhỏ (NSCL) chiếm khoảng 84% trong số 2,2 triệu ca ung thư phổi mới được chẩn đoán mỗi năm trên toàn thế giới, bao gồm khoảng 236.000 ca mới. KRAS G12C là một trong những đột biến trình điều khiển phổ biến nhất trong NSCLC, với khoảng 13% bệnh nhân mắc ung thư phổi không tế bào nhỏ (NSCLC) dạng không vảy có đột biến KRAS G12C.
Cam kết của Amgen về kiểm tra Dấu ấn sinh học toàn diện và Hỗ trợ bệnh nhân
Khoảng 50% số bệnh nhân mắc ung thư phổi không tế bào nhỏ (NSCLC) có đột biến trình điều khiển có thể dùng thuốc nhắm mục tiêu, mặc dù vai trò không thể thiếu của dấu ấn sinh học trong việc xác định những bệnh nhân có thể được hưởng lợi từ các liệu pháp nhắm mục tiêu, nhiều bệnh nhân không được xét nghiệm dấu ấn sinh học.
Amgen đã hợp tác với hai công ty - Guardant Health và QIAGEN để phát triển chẩn đoán đồng hành dựa trên máu và mô (CDx) trước khi dùng LUMAKRAS ™ (Sotorasib). Với việc bổ sung các xét nghiệm này, bệnh nhân và bác sĩ lâm sàng sẽ có nhiều lựa chọn và linh hoạt hơn để tiến hành xét nghiệm dấu ấn sinh học để phát hiện đột biến KRAS G12C.
Xét nghiệm dấu ấn sinh học cho bệnh nhân ung thư phổi không phải tế bào nhỏ là rất quan trọng vì nó thông báo lộ trình điều trị của bệnh nhân bằng cách tiếp cận được cá nhân hóa và điều chỉnh. Là cách duy nhất để xác định đột biến KRAS G12C.
Andrea Ferris - Chủ tịch kiêm Giám đốc điều hành của LUNG Life cho biết: Ngày nay FDA chấp thuận một liệu pháp nhắm mục tiêu KRAS G12C, một trong những dấu ấn sinh học phổ biến nhất trong ung thư phổi không tế bào nhỏ, mang lại hy vọng cho nhiều bệnh nhân mang đột biến này và là một thời điểm quan trọng đối với cộng đồng ung thư phổi, những người cần đổi mới hơn những lựa chọn điều trị.
Amgen cam kết hỗ trợ bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) có đột biến KRAS G12C và giúp những bệnh nhân thích hợp có khả năng tiếp cận LUMAKRAS ™ với chi phí hợp lý. Bệnh nhân, người chăm sóc và bác sĩ cần hỗ trợ, công cụ hoặc nguồn lực có thể liên hệ Amgen Assist 360 ™ (1-888-4ASSIST). Amgen cũng cung cấp hỗ trợ bệnh nhân đối với các loại thuốc được bán trên thị trường bằng nhiều cách khác nhau, bao gồm cả thuốc miễn phí thông qua Amgen Safety Net Foundation dành cho những cá nhân đủ tiêu chuẩn không có hoặc giới hạn bảo hiểm thuốc.
Thuốc LUMAKRAS ™ (Sotorasib)
Hãng Amgen đã thực hiện một trong những thách thức khó khăn nhất trong 40 năm qua trong nghiên cứu ung thư bằng cách phát triển LUMAKRAS ™, một chất ức chế KRAS G12C; LUMAKRAS ™ là chất ức chế KRAS G12C đầu tiên được đưa vào phòng khám và đang được nghiên cứu trong chương trình lâm sàng lớn nhất với sự kết hợp của 11 cơ sở nghiên cứu toàn cầu trải dài khắp năm châu lục.
LUMAKRAS ™ (Sotorasib) đã chứng minh lợi ích, nguy cơ tích cực với hoạt tính chống ung thư nhanh, sâu và bền ở bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) di căn và tiến triển tại chỗ chứa đột biến KRAS G12C với công thức uống một lần mỗi ngày. Là một phần của quá trình đánh giá cho sự chấp thuận nhanh chóng này, FDA đang yêu cầu một thử nghiệm sau khi tiếp thị để điều tra xem liệu liều lượng thấp hơn sẽ có tác dụng lâm sàng tương tự hay không.
LUMAKRAS ™ (Sotorasib) cũng đang được nghiên cứu trong nhiều khối u rắn khác.
LUMAKRAS ™ (Sotorasib) được chỉ định để điều trị bệnh nhân người lớn mắc bệnh ung thư phổi không tế bào nhỏ (NSCLC) di căn hoặc tiến triển tại chỗ đột có biến KRAS G12C, xác định bằng xét nghiệm được FDA chấp thuận, những người đã được điều trị ít nhất một liệu pháp toàn thân trước đó.
Chỉ định này được phê duyệt theo phê duyệt nhanh dựa trên tỷ lệ phản hồi tổng thể (ORR) và thời gian phản hồi (DOR). Việc tiếp tục phê duyệt chỉ định này có thể phụ thuộc vào việc xác minh và mô tả lợi ích lâm sàng trong các thử nghiệm tiếp theo./.
Xem thêm