Lazcluze (Lazertinib)
Thuốc Lazcluze (Lazertinib) là thuốc gì?
Thuốc Lazcluze (Lazertinib) là một chất ức chế tyrosine kinase (TKI) bằng đường uống, thế hệ thứ ba, thụ thể yếu tố tăng trưởng biểu bì (EGFR). Lazcluze (Lazertinib) lần đầu tiên được phê duyệt tại Hàn Quốc vào ngày 18 tháng 01 năm 2021, để điều trị ung thư phổi không tế bào nhỏ (NSCLC) dương tính với đột biến gen EGFR T790M. Nó đã được FDA phê duyệt vào ngày 19 tháng 8 năm 2024. Lazcluze (Lazertinib) được sử dụng một mình hoặc kết hợp với các tác nhân hóa trị liệu khác.
Tháng 11 năm 2024, Ủy ban Sản phẩm Thuốc dùng cho Người của Cơ quan Dược phẩm châu Âu đã thông qua ý kiến tích cực, khuyến nghị cấp phép tiếp thị cho sản phẩm thuốc Lazcluze, dùng kết hợp với Amivantamab, để điều trị ung thư phổi không phải tế bào nhỏ (NSCLC) có đột biến mất đoạn exon 19 của thụ thể yếu tố tăng trưởng biểu bì hoạt hóa (EGFR) hoặc đột biến thay thế exon 21 (L858R). Người nộp đơn xin cấp sản phẩm thuốc này là Janssen-Cilag International NV. Lazertinib đã được chấp thuận sử dụng cho mục đích y tế tại Liên minh Châu Âu tháng 01 năm 2025.
Năm 2018, Janssen Biotech, Inc.(Công ty con của Johnson & Johnson), đã ký kết thỏa thuận cấp phép và hợp tác với Yuhan Corporation để phát triển Lazcluze (Được bán trên thị trường với tên gọi Laclaza tại Hàn Quốc). Lazcluze là thuốc EGFR TKI thế hệ thứ ba, dạng uống, có khả năng thẩm thấu vào não, nhắm vào cả đột biến T790M và đột biến EGFR đang hoạt hóa trong khi vẫn bảo tồn EGFR kiểu hoang dã. Một phân tích về hiệu quả và tính an toàn của Lazcluze từ nghiên cứu LASER 301 giai đoạn 3 đã được công bố trên Tạp chí Ung thư lâm sàng vào năm 2023.
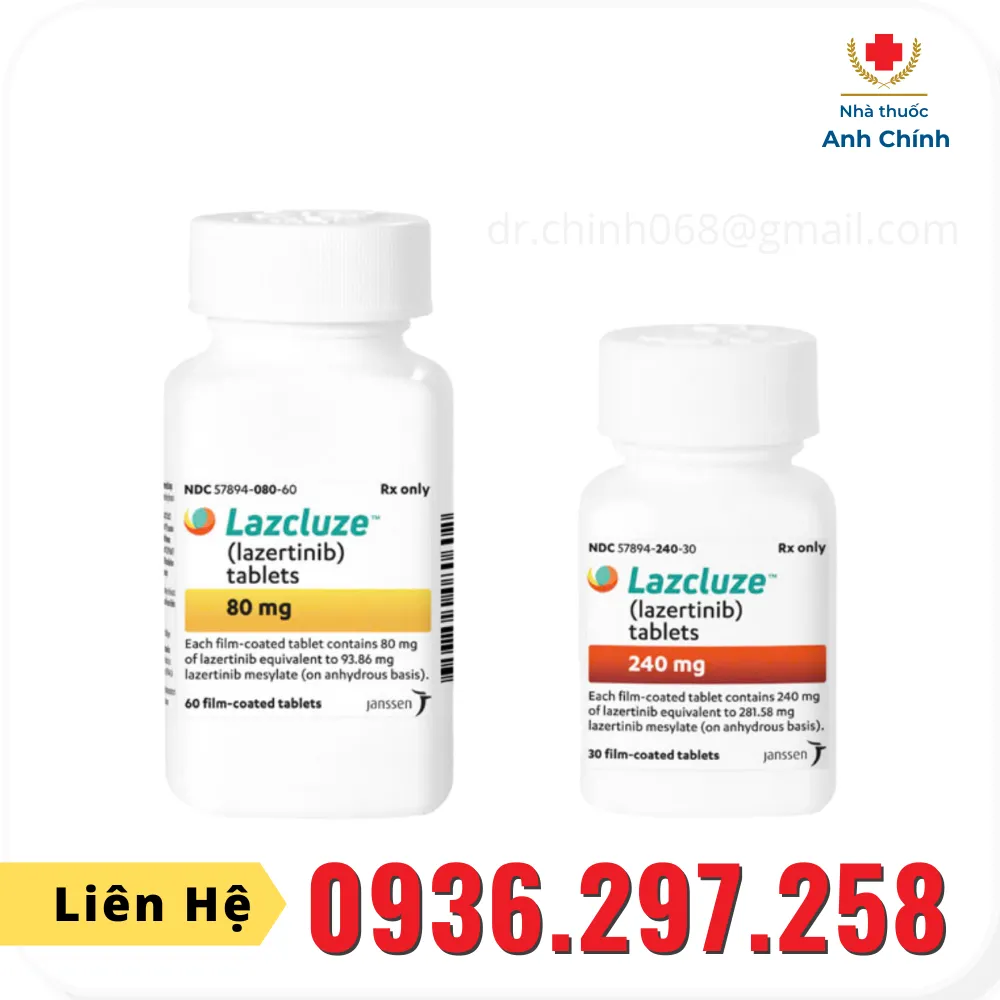
Lazcluze là thuốc dạng viên uống, chứa thành phần Lazertinib, là chất ức chế kinase do Janssen (Công ty con của J&J) phát triển và thương mại hóa. Lazcluze (Lazertinib) được chỉ định kết hợp với Rybrevant (Amivantamab) để điều trị bước đầu (Frist-line treatment) cho bệnh nhân trưởng thành mắc ung thư phổi không phải tế bào nhỏ (NSCLC) tiến triển tại chỗ hoặc di căn có đột biến mất đoạn exon 19 hoặc đột biến thay thế exon 21 (L858R).
Lazcluze được cung cấp dưới dạng viên nén. Liều khuyến cáo là 240 mg uống một lần mỗi ngày cùng hoặc không cùng thức ăn, dùng kết hợp với Amivantamab.
1. Chỉ định
Lazertinib được chỉ định kết hợp với Amivantamab để điều trị đầu tay cho người lớn mắc bệnh ung thư phổi không phải tế bào nhỏ (NSCLC) có đột biến mất đoạn exon 19 của thụ thể yếu tố tăng trưởng biểu bì hoạt hóa (EGFR) hoặc đột biến thay thế exon 21 (L858R).
2. Tác dụng phụ
Tác dụng phụ phổ biến nhất (≥ 20%) là phát ban, độc tính với móng, phản ứng liên quan đến truyền dịch (Amivantamab), đau cơ, phù nề, viêm miệng, huyết khối tắc mạch tĩnh mạch, dị cảm, mệt mỏi, tiêu chảy, táo bón, nhiễm COVID-19, xuất huyết, da khô, chán ăn, ngứa, buồn nôn và độc tính với mắt. Một dấu hiệu an toàn nghiêm trọng về các biến cố huyết khối tắc mạch tĩnh mạch (VTE) đã được quan sát thấy khi dùng Lazertinib kết hợp với Amivantamab và nên dùng thuốc chống đông dự phòng trong 4 tháng đầu điều trị.
Rebrevant (Amivantamab-vmjw) kết hợp với Lazcluze (Lazertinib) có thể gây ra các tác dụng phụ nghiêm trọng, bao gồm:
- Phản ứng liên quan đến truyền dịch. Phản ứng liên quan đến truyền dịch là phổ biến với Rebrevant (Amivantamab-vmjw) có thể không nghiêm trọng hoặc nghiêm trọng như.
|
- Hụt hơi - Sốt - Ớn lạnh - Buồn nôn |
- Tiêu chảy - Khó chịu ở ngực - Chóng mặt - Nôn mửa |
- Các vấn đề về phổi. Rebrevant (Amivantamab-vmjw) có thể gây ra các vấn đề về phổi có thể dẫn đến tử vong. Lazcluze (Lazertinib) cũng có thể gây ra các vấn đề về phổi có thể dẫn đến tử vong. Các triệu chứng có thể tương tự như các triệu chứng của bệnh ung thư phổi.
Hãy báo ngay cho bác sĩ chăm sóc sức khỏe của bạn nếu bạn có bất kỳ triệu chứng phổi mới hoặc xấu đi nào, bao gồm khó thở, ho hoặc sốt.
- Vấn đề về cục máu đông. Cục máu đông là một tác dụng phụ nghiêm trọng nhưng phổ biến của Rebrevant (Amivantamab-vmjw), khi dùng cùng với Lazcluze (Lazertinib), có thể gây ra cục máu đông trong tĩnh mạch ở chân (Huyết khối tĩnh mạch sâu) hoặc phổi (Thuyên tắc phổi) có thể dẫn đến tử vong. Nhà cung cấp dịch vụ chăm sóc sức khỏe của bạn sẽ bắt đầu cho bạn dùng thuốc để ngăn ngừa cục máu đông trong 4 tháng đầu điều trị. Hãy báo cho nhà cung cấp dịch vụ chăm sóc sức khỏe của bạn ngay lập tức nếu bạn có bất kỳ dấu hiệu và triệu chứng nào của cục máu đông, bao gồm sưng, đau hoặc nhạy cảm ở chân, đau ngực đột ngột không rõ nguyên nhân hoặc khó thở.
- Các vấn đề về da. Rebrevant (Amivantamab-vmjw), có thể gây phát ban nghiêm trọng; bao gồm phồng rộp, bong tróc, đau và lở da, đỏ, nổi mụn giống như mụn trứng cá, ngứa và da khô. Lazcluze (Lazertinib) có thể gây phát ban nghiêm trọng bao gồm đỏ, nổi mụn giống như mụn trứng cá, ngứa và da khô. Bạn có thể sử dụng kem dưỡng ẩm không chứa cồn (Không chứa Isopropanol, không chứa Ethanol) để giảm nguy cơ mắc các vấn đề về da.
- Các vấn đề về mắt. Rebrevant (Amivantamab-vmjw), có thể gây ra các vấn đề về mắt. Lazcluze (Lazertinib) cũng có thể gây ra các vấn đề về mắt. Hãy báo ngay cho bác sĩ chăm sóc sức khỏe của bạn nếu bạn có các triệu chứng của các vấn đề về mắt có thể bao gồm:
|
- Đau mắt - Viêm mí mắt - Giác mạc bị viêm - Mắt khô - Đỏ mắt - Nhìn mờ |
- Thay đổi về thị lực - Ngứa mắt - Chảy nước mắt quá nhiều - Nhạy cảm với ánh sáng - Vấn đề mới hoặc xấu đi - Về thị lực |
Bạn không nên sử dụng kính áp tròng cho đến khi các triệu chứng về mắt của bạn được nhà cung cấp dịch vụ chăm sóc sức khỏe kiểm tra.
Các tác dụng phụ phổ biến nhất của Rebrevant (Amivantamab-vmjw) kết hợp với Lazcluze (Lazertinib) bao gồm:
|
- Phát ban - Da bị nhiễm trùng quanh móng - Đau cơ và khớp - Vết loét trong miệng - Sưng ở tay, mắt cá chân, bàn chân, mặt hoặc toàn bộ cơ thể - Cảm giác bất thường trên da (Như ngứa ran hoặc cảm giác kiến bò) - Cảm thấy rất mệt mỏi |
- Tiêu chảy - Táo bón - COVID-19 - Da khô - Chảy máu - Giảm cảm giác thèm ăn - Ngứa da - Buồn nôn - Thay đổi trong một số xét nghiệm máu |
Lazcluze (Lazertinib) có thể gây ra các vấn đề về khả năng sinh sản ở cả nam và nữ, có thể ảnh hưởng đến khả năng sinh con của bạn.
3. Cơ chế hoạt động của thuốc Lazcluze (Lazertinib)
Thuốc Lazcluze (Lazertinib) là một chất ức chế kinase của thụ thể yếu tố tăng trưởng biểu bì đột biến EGFR. Nó nhắm vào các đột biến đơn EGFR (Del ex19, L858R, T790M) và kép (del ex19 / T790M và L858R / T790M). Sự ức chế EGFR loại hoang dã của Lazcluze (Lazertinib) ít chọn lọc và mạnh hơn. Lazcluze (Lazertinib) ức chế EGFR không thể đảo ngược bằng cách hình thành liên kết cộng hóa trị với dư lượng C797S trong vị trí liên kết ATP của miền EGFR kinase. Nó ngăn chặn các dòng thác tín hiệu xuôi dòng EGFR; bao gồm cả quá trình phosphoryl hóa EGFR, AKT và ERK và thúc đẩy quá trình apoptosis của các tế bào ung thư phổi không phải tế bào nhỏ (NSCLC) có đột biến EGFR.
4. Dược lực học của thuốc Lazcluze Lazertinib
Thuốc Lazcluze (Lazertinib) là một thuốc chống ung thư. Trong các tế bào ung thư phổi không tế bào nhỏ (NSCLC) của con người và các mô hình xenograft chuột của gen EGFR xóa exon 19 hoặc đột biến thay thế exon 21 (L858R), Lazcluze (Lazertinib) đã chứng minh hoạt động chống khối u. Điều trị bằng Lazcluze (Lazertinib) kết hợp với Rebrevant (Amivantamab-vmjw) làm tăng hoạt tính chống khối u in vivo so với một trong hai tác nhân đơn thuần trong mô hình xenograft chuột, ung thư phổi không tế bào nhỏ (NSCLC) ở người có đột biến gen EGFR tại exon 21 (L858R).
5. Thử nghiệm
Hiệu quả của sự kết hợp này được đánh giá dựa trên dữ liệu trong MARIPOSA (NCT04487080), là một thử nghiệm đối chứng ngẫu nhiên với hoạt chất, đa trung tâm, trên 1074 bệnh nhân ung thư phổi không phải tế bào nhỏ (NSCLC) có đột biến EGFR mất đoạn exon 19 hoặc đột biến thay thế exon 21 (L858R), tiến triển tại chỗ hoặc di căn và không điều trị toàn thân trước đó.
Bệnh nhân được phân nhóm ngẫu nhiên (2:2:1) để dùng Lazertinib kết hợp với Amivantamab, hoặc đơn trị với Osimertinib hoặc đơn trị với Lazertinib (một phác đồ chưa được chấp thuận cho điều trị NSCLC) cho đến khi bệnh tiến triển hoặc độc tính không thể chấp nhận được.
Mục đánh giá hiệu quả chính là thời gian sống trung bình bệnh không tiến triển (PFS) được đánh giá bởi giám định trung tâm độc lập mù đôi (blinded independent central review: BICR) để so sánh giữa Lazertinib kết hợp Amivantamab và Osimertinib. Thời gian sống còn toàn bộ (OS) là mục đánh giá phụ.
Sự kết hợp Lazertinib với Amivantamab cho thấy sự cải thiện đáng kể về mặt thống kê trong PFS so với Osimertinib với tỷ lệ rủi ro (hazard ratio) là 0,70 (khoảng tin cậy 95% [CI]: 0,58, 0,85; giá trị p = 0,0002). PFS trung vị là 23,7 tháng (95% CI: 19,1, 27,7) ở nhóm Lazertinib kết hợp Amivantamab và 16,6 tháng (95% CI: 14,8, 18,5) ở nhóm Osimertinib.
Mặc dù kết quả OS còn chưa hoàn thiện trong phân tích hiện tại, với 55% số ca tử vong được chỉ định trước cho phân tích cuối cùng được báo cáo, không cho thấy có xu hướng bất lợi nào.
Rybrevant (Amivantamab-vmjw) cộng với Lazcluze (Lazertinib) cho thấy sự cải thiện đáng kể về mặt thống kê và có ý nghĩa lâm sàng về khả năng sống sót tổng thể so với Osimertinib./.
7. Ung thư phổi không phải tế bào nhỏ (NSCLC)
Trên toàn thế giới, ung thư phổi là một trong những loại ung thư phổ biến nhất, trong đó ung thư phổi không tế bào nhỏ (NSCLC) chiếm 80% - 85% tổng số ca ung thư phổi.
Các phân nhóm chính của ung thư phổi không tế bào nhỏ (NSCLC) gồm:
- Ung thư biểu mô tuyến;
- Ung thư biểu mô tế bào vảy;
- Ung thư biểu mô tế bào lớn
Trong số các đột biến gen điều khiển phổ biến nhất ở ung thư phổi không tế bào nhỏ (NSCLC) là những biến đổi trong gen EGFR, đây là một thụ thể tyrosine kinase kiểm soát sự phát triển và phân chia tế bào.
Đột biến EGFR có ở 10% - 15% bệnh nhân phương Tây mắc ung thư phổi không tế bào nhỏ (NSCLC) có mô học là ung thư biểu mô tuyến và xảy ra ở 40% - 50% bệnh nhân châu Á. Đột biến gen EGFR ex19del hoặc gen EGFR L858R là những đột biến EGFR phổ biến nhất. Tỷ lệ sống sót sau 5 năm đối với tất cả những người mắc ung thư phổi không tế bào nhỏ (NSCLC) tiến triển và đột biến EGFR được điều trị bằng thuốc ức chế tyrosine kinase (TKI) là dưới 20%. Đột biến chèn exon 20 của EGFR là đột biến hoạt hóa EGFR phổ biến thứ ba. Bệnh nhân có đột biến chèn exon 20 của EGFR có tỷ lệ sống sót chung (OS) 5 năm thực tế là 8% trong bối cảnh tuyến đầu, tệ hơn so với bệnh nhân có đột biến EGFR ex19del hoặc L858R, những người có OS 5 năm thực tế là 19%./.
Mua thuốc Lazcluze (Lazertinib) 80mg và 240mg ở đâu? |
|
Để mọi bệnh nhân được dùng đúng thuốc với giá tốt Ths, Bs: LÊ VĂN CHÍNH Liên hệ SĐT: 0936.297.258 Đảm bảo tư vấn tận tình, hàng chính hãng với giá tốt nhất! Chúng tôi cung ứng thuốc toàn quốc! Lào Cai, Yên Bái, Điện Biên, Hòa Bình, Lai Châu, Hà Giang, Cao Bằng, Bắc Kạn, Lạng Sơn, Tuyên Quang, Thái Nguyên, Phú Thọ, Bắc Giang, Quảng Ninh, Bắc Ninh, Hà Nam, Hải Dương, Hưng Yên, Hải Phòng, Nam Định, Ninh Bình, Thái Bình, Vĩnh Phúc. Thanh Hóa, Nghệ An, Quảng Bình, Quảng Trị, Thừa Thiên Huế, Đà Nẵng, Quảng Nam, Quảng Ngãi, Bình Định, Phú Yên, Khánh Hòa, Ninh Thuận, Bình Thuận, Kon Tum, Gia Lai, Đắc Lắk, Đắc Nông, Lâm Đồng. Đồng Nai, Bà Rịa - Vũng Tàu, Bình Dương, Bình Phước, Tây Ninh, Cần Thơ, Long An, Tiền Giang, Bến Tre, Vĩnh Long, Trà Vinh, Đồng Tháp, An Giang, Kiên Giang, Hậu Giang, Sóc Trăng, Bạc Liêu, Cà Mau. Thuốc có sẵn tại Hà Nội và TP. Hồ Chí Minh. Tại các tỉnh và thành phố khác, giao hàng chuyển phát nhanh qua đường bưu điện. |
Thuốc Tenohet (Tenofovir Alafenamide) 25 mg
500.000đ
Tên thuốc: Tenohet Thành phần: Tenofovir Alafenamide Viên nén: 25mg Đóng gói hộp: 30 viên Nhà sản xuất: Heet Healthcare PVT. LTD. Xuất xứ: Ấn Độ
Thuốc Firmonertinib 40mg
Tên thuốc: Firmonertinib Thành phần: Firmonertinib Viên nang: 40 mg Đóng gói hộp: 28 viên Nhà sản xuất: Allist Pharmaceuticals Co., Ltd., Xuất xứ: Trung Quốc
Thuốc Alpesib 150 mg
- Tên thuốc: Alpesib - Thành phần: Alpelisib - Viên nang: 150 mg - Đóng gói: 28 viên/hộp - Nhà sản xuất: Everest Pharmaceuticals Ltd. - Xuất xứ: Bangladesh
Thuốc Regonat (Regorafenib) 40mg
- Tên thuốc: Regonat - Thành phần: Regorafenib - Viên nén: 40 mg - Đóng gói: 28 viên/hộp - Nhà sản xuất: Natco Pharma Limited. - Xuất xứ: Ấn Độ
Thuốc Alkixen (Crizotinib) 250mg
- Tên thuốc: Alkixen - Thành phần: Crizotinib - Viên nang: 250 mg - Đóng gói: 60 viên/hộp - Nhà sản xuất: Everest Pharmaceuticals Ltd. - Xuất xứ: Bangladesh
Thuốc ZYKADIA (Ceritinib) 150mg
- Tên thuốc: ZYKADIA; - Thành phần: Ceritinib; - Dạng bào chế: Viên nang 150mg; - Đóng gói: Hộp 50 viên; - Nhà sản xuất: NOVARTIS.
Thuốc Alecnib 150mg
- Tên thuốc: Alecnib 150mg - Viên nang: 150mg - Đóng gói: 56 viên nang/ Hộp - Nhà sản xuất: Everest Pharmaceuticals Ltd. - Xuất xứ: Bangladesh.
Keytruda (Pembrolizumab) 25mg
Keytruda (Pembrolizumab): Hoạt động với hệ thống miễn dịch của bạn để giúp chống lại các tế bào ung thư. Keytruda không phải là hóa trị hoặc xạ trị - Keytruda là một liệu pháp miễn dịch và nó hoạt động với hệ thống miễn dịch của bạn để giúp chống lại một số bệnh ung thư.
Thuốc Tenfoplus (Tenofovir Alafenamide) 25mg
Tên thuốc: Tenfoplus 25 mg Thành phần: Tenofovir Alafenamide Viên nén: 25 mg Đóng gói lọ/hũ: 30 viên Tên thương mại và phân phối thuộc Abbott India Limited Xuất xứ: India
Thuốc QINLOCK 50 mg (Ripretinib)
Tên thuốc: QINLOCK Thành phần: Ripretinib Viên nén: 50mg Đóng gói hộp: 90 viên (đủ dùng cho 1 tháng điều trị) Nhà sản xuất: Deciphera Pharmaceuticals, Inc
Thuốc ERLOCIP 150mg (Erlotinib)
1.900.000đ
Tên thuốc: ERLOCIP 150 Thành phần: Erlotinib 150mg Viên nén: 150mg Đóng hộp/hũ: 30 viên (đủ dùng cho 1 tháng điều trị) Nhà sản xuất: Cipla LTD Xuất xứ: INDIA
Thuốc TAGRISSO (Osimertinib) 80mg
Mua thuốc Tagrisso điều trị ung thư phổi chính hãng. Liên hệ Bs Chính qua hotline 096 658 1290. Tư vấn và cung cấp thuốc toàn quốc. Tên thương mại: Tagrisso 80mg Thành phần: Osimertinib Hàm lượng: 80mg Dạng: Viên nén Đóng gói: Hộp chữ nhật 30 viên
Thuốc Briganix 90mg/ Briganix 180mg
Các loại thuốc có thể làm tăng nồng độ huyết tương Briganix (Brigatinib): Các chất ức chế CYP3A mạnh: Dùng đồng thời itraconazole, chất ức chế CYP3A mạnh, làm tăng nồng độ Briganix (Brigatinib) trong huyết tương và có thể dẫn đến tăng phản ứng bất lợi. Tránh sử dụng đồng thời các thuốc ức chế CYP3A mạnh với Briganix (Brigatinib), bao gồm nhưng không giới hạn ở một số loại thuốc chống siêu vi (ví dụ: boceprevir,
Okinawa Fucoidan Kanehide Bio 150 viên (Fucoidan-đỏ)
1.400.000đ
- Tên sản phẩm: Okinawa Fucoidan Kanehide Bio - Hàm lượng: 300 mg/viên - Mỗi viên chứa: 167 mg Fucoidan nguyên chất - Nhà sản xuất: Kanehide Biotechnology Co., Ltd. - Xuất xứ: Okinawa - Nhật Bản - Đóng gói: 150 viên/Lọ - Dạng bào chế: Viên nang
Thuốc Tykerb 250mg
Tên thuốc: Tykerb 250mg Thành phần: Lapatinib Viên nén: 250mg
Thuốc Tarceva 150mg
Nhà chế tạo: Roche Thành phần: Erlotinib 150mg
Thuốc IRESSA 250 mg
Tên thương mại: IRESSA 250mg Thành phần: Gefitinib Dạng: Viên nén bao phim Nhà sản xuất: AstraZeneca
Thuốc Hepbest 25mg
Tên thuốc: HepBest 25mg Thành phần, hàm lượng: Mỗi viên nén bao phim có chứa Tenofovir Alafenamide 25 mg Dạng bào chế: Viên nén bao phim; hình thuôn dài màu trắng hoặc ngà trắng có khắc chữ M ở một mặt và chữ TFI ở mặt còn lại. Đóng gói: Hộp 30 viên. Nhà sản xuất: Mylan Laboratories Limited Xuất xứ: Ấn Độ
Thuốc Osimert 80mg
Tên Thuốc: Osimert 80mg Thành phần: Osimertinib 80mg (dạng viên nén) Hộp: 30 viên nén Nhà sản xuất: Everest Pharmaceuticals Ltd., Xuất xứ: Bangladesh
Thuốc Osicent 80mg
Tên thương mại: Osicent 80mg Thành phần: Osimertinib Hàm lượng: 80mg Dạng: Viên nén Đóng gói: Hộp giấy chứa lọ 30 viên Nhà phân phối: Incepta Pharmaceuticals Ltd., Xuất xứ: Bangladesh Thuốc Osicent mua ở đâu giá rẻ nhất và uy tín nhất? Chúng tôi là đơn vị cung cấp thuốc Osicent 80mg chính hãng trên toàn quốc. Hãy gọi 0966.58.1290






















Xem thêm